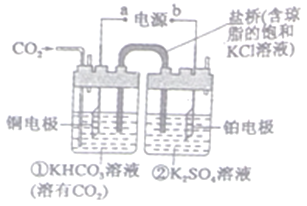
题目内容
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
A. XeF2分子中各原子均达到八电子结构
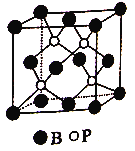
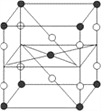
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
【答案】C
【解析】Xe原子本身就是8电子结构,再与F原子结合,肯定就不再是八电子结构了,故A错;晶胞中Xe原子个数为:8×![]() +1=2,F原子个数为:8×
+1=2,F原子个数为:8×![]() +2=4,故原子个数比Xe:F=1:2,其化学式为XeF2,故B错误;由题中化学方程式可知,生成3molO2失12mol电子,生成2molXeO3失4mol电子,生成4molXe得16mol电子,所以转移电子总数为16mol,故C正确;F2与水会剧烈反应,所以在溶液中不可能生成F2,故D错误。
+2=4,故原子个数比Xe:F=1:2,其化学式为XeF2,故B错误;由题中化学方程式可知,生成3molO2失12mol电子,生成2molXeO3失4mol电子,生成4molXe得16mol电子,所以转移电子总数为16mol,故C正确;F2与水会剧烈反应,所以在溶液中不可能生成F2,故D错误。

【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D