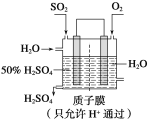
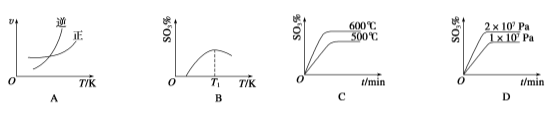
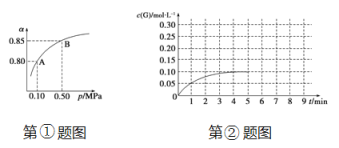
��Ŀ����
����Ŀ�����������һ�ֵ��͵�ǿ�����������������գ�
��������KMnO4������Һ����Cu2S��CuS�Ļ����ʱ�������ķ�Ӧ���£�
�� MnO4��+ Cu2S + H+�� Cu2+ + SO2�� + Mn2+ + H2O(δ��ƽ)
�� MnO4��+ CuS + H+ �� Cu2+ + SO2�� + Mn2+�� H2O(δ��ƽ)
��1�����й��ڷ�Ӧ����˵���д������ ��ѡ���ţ���
a����������Ԫ����Cu��S
b���������뻹ԭ�������ʵ���֮��Ϊ8:5
c����ԭ�Ե�ǿ����ϵ�ǣ� Mn2+<Cu2S
d������2.24 L(�����) SO2��ת�Ƶ��ӵ����ʵ�����0.6mol
��2�������Ӧ���е���ת�Ƶķ������Ŀ�� MnO4��+ CuS
������ϡ�����У�MnO4����H2O2Ҳ�ܷ���������ԭ��Ӧ
������Ӧ��H2O2��2e-�� 2H++O2��
��ԭ��Ӧ��MnO4��+5e-+8H+��Mn2++4H2O
��3����Ӧ������0.5 mol H2O2�μӴ˷�Ӧ��ת�Ƶ��ӵĸ���Ϊ ����������Ӧ�ó�������������ǿ���Ľ����� >_________(��д��ѧʽ)��
��4����֪��2KMnO4+7H2O2+3H2SO4�� K2SO4+2MnSO4+6O2��+10H2O����1molKMnO4������H2O2�� mol��
���𰸡���1��d
��2��![]()
��3��6.02��1023 �� KMnO4> H2O2(��O2)
��4��2.5
��������
���������I����1��a����Ӧ��ͭԪ�ػ��ϼ۴�+1�����ߵ�+2�ۣ���Ԫ�ػ��ϼ۴�-2�����ߵ�+4�ۣ����ϼ����ߵ�Ԫ�ر����������Ա�������Ԫ����S��Cu����a��ȷ��b����Ԫ�ػ��ϼ۽��ͣ���+7�۽���Ϊ+2�ۣ�Cu2SԪ�ػ��ϼ۶���������ԭ����1molMnO4-�õ�5mol���ӣ���Ӧ��ͭԪ�ػ��ϼ۴�+1�����ߵ�+2�ۣ���Ԫ�ػ��ϼ۴�-2�����ߵ�+4�ۣ�1molCu2Sʧȥ8mol���ӣ����������뻹ԭ�������ʵ���֮��Ϊ8��5����b��ȷ��c��������ԭ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ���ԭ�Ե�ǿ����ϵ�ǣ�Mn2+��Cu2S����c��ȷ��d������2.24LL������£�SO2ʱ�����ʵ���Ϊ0.1mol����Ӧ��Cu2S���ʵ���Ϊ0.1mol����Ӧ��ת�Ƶ��ӵ����ʵ����ǣ�
Cu+��Cu2+��e-�� S2-��SO2��6e-��
1 1 1 6
0.2mol 0.2mol 0.1mol 0.6mol
���Ե���ת�ƹ�0.8mol����d���ʴ�Ϊ��d��
��2�������ɵã���Ԫ�ػ��ϼ���+7����+2����Ԫ�ػ��ϼ���-2����+4�����ݵ�ʧ�����غ�ã�6MnO4-+5CuS+�� ����ԭ����CuS����������MnO4-������ת�Ƶķ��������ĿΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
������3��H2O2��OԪ����-1�۱��0�ۣ���Ӧ������0.5 mol H2O2�μӴ˷�Ӧ��ת�Ƶ��ӵĸ���Ϊ0.5 mol����1-0����2��6.02��1023 = 6.02��1023 ��������������������ǿ����������������ԣ�������KMnO4> H2O2(��O2)���ʴ�Ϊ��6.02��1023 �� KMnO4> H2O2(��O2) ��
��4��KMnO4����Ԫ����+7�۱��+2�ۣ�H2O2��OԪ����-1�۱��0�ۣ����ݵ�ʧ�����غ㣬1molKMnO4������H2O2�����ʵ���Ϊ![]() =
=![]() mol���ʴ�Ϊ��
mol���ʴ�Ϊ��![]() ��
��

 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
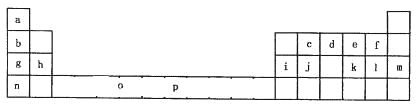
�Իش��������⣺
��1��Ԫ��pΪ26��Ԫ�أ��뻭�����̬ԭ����Χ�����Ų�ͼ______________��
��2��e��a��Ӧ�IJ���ķ���������ԭ�ӵ��ӻ���ʽΪ________________���÷�����_________�����������������Ǽ����������ӡ�
��3���ϱ���Ԫ�ػ�̬ԭ�ӵĵ�һ��������Ԫ����__________������Ԫ�ط��ű�ʾ��
��4��o��p��Ԫ�صIJ��ֵ��������������±���
Ԫ �� | O | P | |
������ | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
�Ƚ���Ԫ�ص�I2��I3��֪����̬o2+��ʧȥһ�����ӱ���̬p2+��ʧȥһ�������ѣ��Դˣ���Ľ�����______________��
����Ŀ����2016�캪��һģ������ѧѡ��3�����ʽṹ�����ʡ�
���ʹ�������ǿ����������ܵ���Ҫ�о�����
��1��Ti(BH4)3��һ�ִ�����ϣ�����TiCl4��LiBH4��Ӧ�Ƶá�
����̬Clԭ���У�����ռ�ݵ�����ܲ����Ϊ_________�����ܲ���е�ԭ�ӹ����Ϊ________��
��LiBH4��Li+��BH4-���ɣ�BH4-������ṹ��_________��Bԭ�ӵ��ӻ����������________��
Li��B��HԪ�صĵ縺���ɴ�С����˳��Ϊ________��
��2�������⻯���Ǿ������÷�չǰ���Ĵ�����ϡ�
��LiH�У����Ӱ뾶Li+_______H-(������������=����������)����ij��������ǵ������ڽ���Ԫ��M���⻯�M�IJ��ֵ����������ʾ��
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M��________ (��Ԫ�ط���)��
��3��NaH����NaCl�;���ṹ����֪NaH����ľ�������a=488pm(�ⳤ)��Na+�뾶Ϊ102pm��H-�İ뾶Ϊ________��NaH�������ܶ���___________g��cm-3(ֻ����ʽ�����ؼ������ֵ�������ӵ�����ΪNA)