题目内容
【题目】【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g)![]() SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
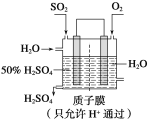
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。
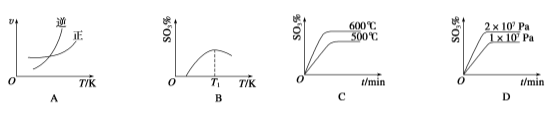
(4)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,一定正确的是________(填序号)。
2SO3(g)反应的图像中,一定正确的是________(填序号)。
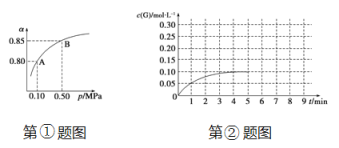
(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。
【答案】(1)![]() (2分)(2)ACF (2分)(3)SO2+2H2O-2e-=SO42-+4H+(2分) (4) ABD(2分)
(2分)(2)ACF (2分)(3)SO2+2H2O-2e-=SO42-+4H+(2分) (4) ABD(2分)
(5) ① =(1分) ②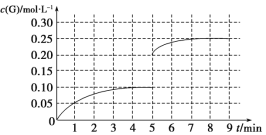 (1分)
(1分)
【解析】
试题分析:(1)反应达到平衡时共放出196kJ的热量,根据热化学方程式可知反应了2.0mol SO2和1.0mol O2,则
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(molL1) 0.04 0.1 0
转化浓度(molL1) 0.02 0.01 0.02
平衡浓度(molL1) 0.02 0.09 0.02
该温度下的平衡常数K=![]() 。
。
(2)A、保持温度和容器体积不变,充入2molSO3,平衡向逆反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,A正确;B、保持温度和容器体积不变,充入2molN2,对平衡移动没有影响,各物质的浓度不变,B错误;C、保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2,平衡向正反应方向进行,再次平衡后各物质的浓度均增大,C正确;D、保持温度和容器内压强不变,充入1molSO3,处于等效平衡状态,浓度不变,D错误;E、升高温度,平衡向逆反应方向移动,SO3的浓度减小,E错误;F、移动活塞压缩气体浓度均增大,F正确,答案选ACF。
(3)依据图中所示装置,二氧化硫失电子发生氧化反应,在水溶液中转化为硫酸;电极反应为SO2+2H2O-2e-=SO42-+4H+。
(4)A、温度升高,平衡逆向移动,逆反应速率增加的倍数大,A正确;B、图像的前半段为反应建立平衡的过程,SO3%逐渐增大,T1之后的阶段为化学反应随温度的升高平衡移动的过程,升高温度,平衡逆向移动SO3%逐渐减小,图像正确,B正确;C、600℃高于500℃,平衡逆向移动,SO3%逐渐减小,图像错误,C错误;D、增大压强,平衡正向移动,SO3%增大,图像正确,D正确,答案选ABD。
(5)①平衡常数只与温度有关系,温度不变,平衡常数不变,即K(A)=K(B)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,压强增大,物质的浓度瞬间变为原来的2倍,平衡向正反应方向进行,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1),则此变化过程中SO3(g)浓度的变化曲线可表示为 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
选项 | 甲物质 | 乙组中的物质 |
A | SO2 | 淀粉碘化钾溶液、氨水、KMnO4溶液、碳酸钠溶液 |
B | Mg | Cl2、CO2、NH4Cl溶液、NaOH溶液 |
C | SiO2 | 碳、NaOH溶液、氢氟酸、Na2CO3 |
D | 稀硫酸 | Al(OH)3、碳、Cu2(OH)2CO3、Cu |

