题目内容
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O氯化完成后过滤。
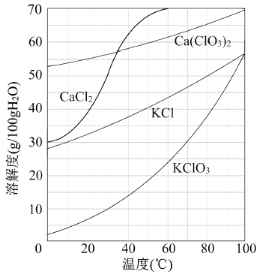
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
【答案】(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;②AB (2)①CaCO3、Ca(OH)2 ②<;
(3)蒸发浓缩、冷却结晶
【解析】
试题分析:(1)①氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,则生成Ca(ClO)2的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O。
②A.适当减缓通入Cl2速率可以使氯气被氢氧化钙充分吸收而反应,可以提高氯气的转化率,A正确;B.充分搅拌浆料可以增大反应物的接触面积,使氯气被氢氧化钙充分吸收而反应,可以提高氯气的转化率,B正确;C.加水使Ca(OH)2完全溶解氢氧化钙浓度降低,不利于氯气的吸收,C错误,答案选AB。
(2)①碳酸钙不溶于水,与氯气不反应,氢氧化钙微溶,因此滤渣的主要成分为CaCO3、Ca(OH)2。
②由于氯气还能与氢氧化钙反应生成次氯酸钙、氯化钙和水,因此滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2]<1∶5。
(3)根据图像可知氯酸钾的溶解度受温度影响最大,因此从该溶液中尽可能多地析出KClO3固体的方法是蒸发浓缩、冷却结晶。

 阅读快车系列答案
阅读快车系列答案