题目内容
【题目】镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H 2 (g)=MgH 2 (s) △H 1 =-74.5kJ·mol -1
Mg 2 Ni(s) + 2H 2 (g)=Mg 2 NiH 4 (s) △H 2 =-64.4kJ·mol -1
Mg 2 Ni(s)+2MgH 2 (s) = 2Mg(s)+Mg 2 NiH 4 (s) △H 3
则△H 3 = kJ·mol -1 。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl 2 ·6H 2 O转化为MgCl 2 ·NH 4 Cl·nNH 3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4) 2 在110~200°C的反应为:Mg(AlH4) 2 =MgH 2 +2Al+3H 2 ↑每生成27gAl转移电子的物质的量为 。
【答案】(1)+84.6
(2)MgCl2 ·NH4Cl·nNH3 ![]() MgCl 2 +(n+1)NH 3 ↑ + HCl↑ ; Mg2+ +2e-= Mg;
MgCl 2 +(n+1)NH 3 ↑ + HCl↑ ; Mg2+ +2e-= Mg;
(3)3mol
【解析】
试题分析:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJmol-1,②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJmol-1,Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3,由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4kJ/mol-2×(-74.5kJ/mol)=+84.6kJ/mol,则△H3=+84.6kJ/mol,故答案为:+84.6;
(2)MgCl2NH4ClnNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2NH4ClnNH3![]() MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;故答案为:MgCl2NH4ClnNH3
MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;故答案为:MgCl2NH4ClnNH3![]() MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,故答案为:3mol。

【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
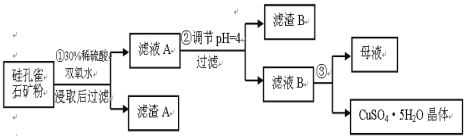
(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2) 步骤②调节溶液pH,可以选用的试剂是______
A. CuO B.Fe2O3 C.Al2O3 D Cu(OH)2
(3) 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 、 。
(4) 将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5) 测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果__ ___(填“偏高”、“偏低”或“不变”)。