题目内容
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
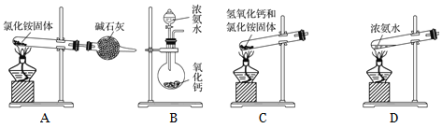
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。

(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
【答案】![]() D
D ![]() A
A ![]() Ca(OH)2+2NH4Cl
Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O AC NH3H2O
CaCl2+2NH3↑+2H2O AC NH3H2O![]() NH4++OH 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体
NH4++OH 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体
【解析】
(1)氮原子的核电荷数是7;
(2)氮气分子为两个氮原子通过共用3对电子形成共价键,该N≡N非常稳定,破坏需要吸收很高的能量,据此解答;
(3)N2分子中存在氮氮叁键,将空气中的氮气转化为氮的化合物的过程称为固氮,结合氨元素的形态变化判断即可;
(4)氨气是共价化合物,存在3个N-H键;
(5)加热消石灰与氯化铵固体得氨气、氯化钙和水;
(6)A.NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl;
B.CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
C.固体加热制气体时,试管口应略向下倾斜;
D.根据浓氨水易挥发分析;
(7)氨气极易溶解于水生成NH3H2O,使烧瓶内压强迅速减小,形成喷泉;
(8)喷泉实验需形成明显的压力差;
(9)碳酸氢铵不稳定,易分解生成氨气;氨气能使湿润的红色石蕊试纸变蓝色。
(1)N原子核外有7个电子,核外电子排布是2、5,则N原子结构示意图为:![]() ;
;
(2)A.氮分子是双原子分子,但双原子分子组成的物质可能活泼,如Cl2,N2不容易反应与是否是双原子分子无关,故A错误;
B.氮元素的非金属性很强,原子获得电子能力强,氮气要参加反应,首先应该变为单个原子,因此不能证明氮气性质不活泼,故B错误;
C.氮原子的半径较小,原子获得电子能力强,与氮气性质不活泼无关,故C错误;
D.N2是双原子分子,2个N原子共用三对电子,断裂N≡N需要消耗很高的能量,因此氮气不容易参加化学反应,D故正确;
故答案是D;
(3)N2分子中2个N原子形成3个共价键,使每个N原子都达到稳定结构,所以N2的电子式:![]() ;将空气中的氮气转化为氮的化合物的过程称为固氮。
;将空气中的氮气转化为氮的化合物的过程称为固氮。
A.N2和H2在一定条件下反应生成NH3,氮元素的单质变为化合物,属于人工固氮,故A正确;
B.雷雨闪电时空气中的N2和O2化合生成NO,氮元素的单质变为化合物,属于氮的固定,是自然固氮,故B错误;
C.NH3经过催化氧化生成NO,是N元素的化合物的转化,不是氮的固定,故C错误;
D.NH3和HNO3反应生成NH4NO3,是N元素的化合物的转化,不是氮的固定,故D错误;
故答案为A;
(4)在NH3中,N原子最外层有5个电子,N原子与三个H原子形成3个共价键,从而使每个原子都达到稳定结构,NH3的电子式:结合形成NH3,所以NH3的电子式为![]() ;
;
(5)消石灰与氯化铵固体混合加热产生氨气、氯化钙和水,此反应的化学方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(6)A.氯化铵不稳定受热易分解,但是氨气与氯化氢遇冷又极易反应生成氯化铵固体,不能用于制备氨气,故A错误;
B.向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,有利于浓氨水中的氨气逸出,故B正确;
C.固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,所以利用氯化铵和氢氧化钙固体加热制取氨气需试管口应略向下倾斜,故C错误;
D.浓氨水易挥发,加热能够促进氨气的逸出,可以用来制备氨气,故D正确;
故答案为AC;
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,当挤压滴管的胶头时,水进入烧瓶中,氨气溶于水,使烧瓶内气体压强减小,烧杯内的水不断进入烧瓶,由于氨气溶于形成的一水合氨电离产生NH4+、OH,水溶液显碱性,因此可以得到红色喷泉,用方程式表示为:NH3H2O![]() NH4++OH;
NH4++OH;
(8)如果只提供如图2的装置,引发喷泉的方法是打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉;
(9)NH4NO3是常用的铵态氮肥,在施用时若受热,就会发生分解反应释放出氨气而降低肥效;检验NH4+的方法是加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体。

 阅读快车系列答案
阅读快车系列答案【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |