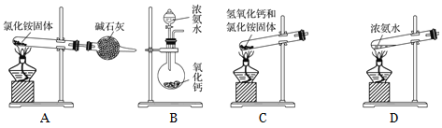
题目内容
【题目】门捷列夫发现化学元素的周期性,依照原子量,制作出世界上第一张元素周期表,并据以预见了一些尚未发现的元素。
完成下列填空:

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。___
(2)在上表标出的①一⑦号元素中,可以形成化合物种类最多的是___(请填写元素符号,下同),通常情况下不易与其他物质发生反应的是___。
(3)元素1与元素2金属性较强的是___(填元素符号),请解释理由__。
(4)下列事实可以用来判断元素5与6的非金属性强弱的是____。(填序号)
A.两种元素气态氢化物的沸点高低
B.两种元素形成的化合物中元素5显正价
C.两种元素最高价氧化物对应水化物的酸性强弱
D.元素6单质能将元素5从它的氢化物中置换出来
(5)锡(Sn)是很早便被发现和使用的金属,其原子结构示意图见图。

请在上表相应位置填入锡的元素符号。___。
(6)SnO2能与NaOH反应生成钠盐,写出反应的化学方程式___,这个反应可以说明锡元素具有____(填“金属性”或“非金属性”)。锡溶于盐酸得到溶液A,向A中通入氯气,氯气被还原。写出在A中反应的化学方程式____。
(7)解释表中卤化锡的熔、沸点的变化规律___。

【答案】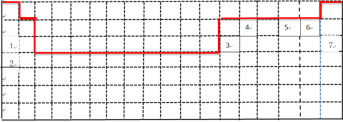 C Ar K 同主族元素,随着电子层数越多,半径逐渐增大,原子核对最外层电子的吸引力就越弱,原子就越容易失去电子,而不容易得电子,所以金属性K比Na更强 BD
C Ar K 同主族元素,随着电子层数越多,半径逐渐增大,原子核对最外层电子的吸引力就越弱,原子就越容易失去电子,而不容易得电子,所以金属性K比Na更强 BD 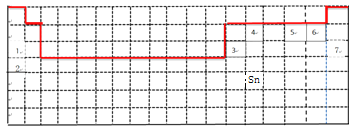 SiO2+2NaOH=Na2SiO2+H2O 非金属性 SiCl2+Cl2=SnCl4 三者都为分子晶体,且分子构型相同,故SnCl4、SnBr4、SnI4分子量逐渐增大,范德华力逐渐增大
SiO2+2NaOH=Na2SiO2+H2O 非金属性 SiCl2+Cl2=SnCl4 三者都为分子晶体,且分子构型相同,故SnCl4、SnBr4、SnI4分子量逐渐增大,范德华力逐渐增大
【解析】
由元素在周期表的位置可知:1是钠元素,2是钾元素,3是铝元素,4是碳元素,5是氧元素,6是氟元素,7是氩元素。
(1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图: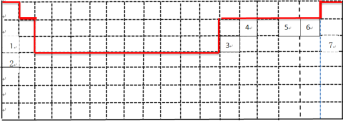 ,
,
故答案为: ;
;
(2)有机化合物最多,上表标出的①一⑦号元素中,可以形成化合物种类最多的是碳通常情况下不易与其他物质发生反应的是氩;
(3)元素1与元素2金属性较强的是K,原因是同主族元素,随着电子层数越多,半径逐渐增大,原子核对最外层电子的吸引力就越弱,原子就越容易失去电子,而不容易得电子,所以金属性K比Na更强;
(4)A. 沸点是物理性质,不能用来比较非金属强弱,故错误;
B. 两种非极性元素形成化合物,非金属性强表现负价,弱的表现正价,故正确;
C. 氟元素没有最高正价,故错误;
D. 非金属性强的单质可以把非金属性弱元素从它的化合物中置换出来,故正确;
故选:BD;
(5)锡(Sn)最外层4个电子,电子层数是五,所以处于第五周期,第IVA族,然后填入即可;
(6)SnO2能与NaOH反应生成钠盐,反应的化学方程式SnO2+2NaOH=Na2SnO2+H2O,该反应说明锡元素具有非金属性,锡溶于盐酸得到溶液A,向A中通入氯气,氯气被还原,由信息可知A中反应的化学方程式SiCl2+Cl2=SnCl4;
(7)有表中数据可知三者都是都为分子晶体,且分子构型相同,故SnCl4、SnBr4、SnI4分子量逐渐增大,范德华力逐渐增大。

【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
【题目】在体积为2L的恒容密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
实验序号 | 时间 物质的量 温度 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 490℃ | 2.00 | 1.00 | 0.50 | 0.30 | 0.25 | 0.20 | 0.20 |
2 | 490℃ | 2.00 | 0.30 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
3 | 500℃ | 2.00 | 0.50 | 0.35 | 0.30 | 0.30 | 0.30 | 0.30 |
(1)对照实验1,实验2改变的某一外界条件可能是_______。
(2)反应达平衡后,向实验2中加入少量的18O2,一段时间18O后可能存在于哪些物质中________(填选项)。
A 只存在氧气 B 只存在三氧化硫 C 只存在反应物 D 存在反应物与生成物
(3)实验3中,在5~15min时段,用O2表示的平均反应速率为______ mol/(L·min)。
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,则参加反应的SO2和O2的总能量______(填“>”、“<”或“=”)生成的SO3的总能量。
(5)能说明实验3达到平衡状态的标志是_______(任写一条)。