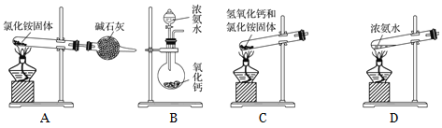
题目内容
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空,5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程。如图:
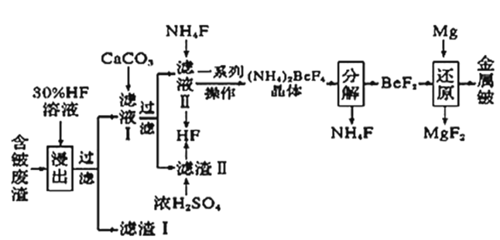
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有___、__(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:__。
(2)该流程中可循环利用的物质是__;滤渣Ⅱ与浓硫酸发生反应的化学方程式为___;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指__过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为___;“还原”过程可以用金属镁制备金属铍的原因是__。
【答案】粉碎废渣 增大HF溶液的浓度适当升高温度、充分搅拌 Be+4HF=H2BeF4+H2↑ HF、NH4F CaF2+H2SO4(浓)![]() CaSO4+2HF↑ 蒸发浓缩、冷却结晶
CaSO4+2HF↑ 蒸发浓缩、冷却结晶 ![]() 镁的还原性比铍强
镁的还原性比铍强
【解析】
由流程可知,含铍废渣以氢氟酸浸取,过滤后得到滤渣I为MgF2,滤液I中加入碳酸钙后过滤,得到滤渣II(CaF2)和滤液II;向滤液II中加入氯化铵,经一系死操作得到(NH4)2BeF4晶体,该晶体经分解得到氟化铍;氟化铍用镁还原得到金属铍。
(1)含铍废渣以30%的氢氟酸浸取,要提高浸出速率,可以采用的方法有粉碎废渣或充分搅拌以提高反应物的接触面积,也可以适当增大HF溶液的浓度或适当升高温度;滤液Ⅰ中铍元素的存在形式为H2BeF4,则废渣听金属铍在“浸出”过程中发生反应的化学方程式为Be+4HF=H2BeF4+H2↑。
(2)由流程可知,滤渣II经浓硫酸处理后以及滤液II与氟化铵反应后均可生成HF,而(NH4)2BeF4分解后可以生成氯化铵,由于该流程中要用到氢氟酸和氟化铵,故该流程中可循环利用的物质是HF、NH4F;滤渣Ⅱ与浓硫酸发生反应,是利用难挥发酸制备挥发性酸,该反应的化学方程式为CaF2+H2SO4(浓)![]() CaSO4+2HF↑;由于(NH4)2BeF4易溶于水,其在水中的溶解度随温度的升高而大幅度增大,而且其受热易分解,故从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”应包括:、过滤、洗涤、干燥。
CaSO4+2HF↑;由于(NH4)2BeF4易溶于水,其在水中的溶解度随温度的升高而大幅度增大,而且其受热易分解,故从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”应包括:、过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,则其为共价化合物,故其电子式为![]() ;由于铍和镁均为第IIA的元素,镁的金属性强于铍,因此,“还原”过程可以用金属镁制备金属铍的原因是:镁的还原性比铍强。
;由于铍和镁均为第IIA的元素,镁的金属性强于铍,因此,“还原”过程可以用金属镁制备金属铍的原因是:镁的还原性比铍强。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。