题目内容
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。完成下列填空:
(1)砷原子核外有____个电子层,最外层有_____个电子。
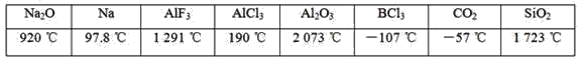
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列_____(用元素符号表示)
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:_____强于____(填物质的化学式)
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因______。
【答案】4 5 N<P<As HBrO4 H3AsO4 Al(OH)3 ![]() H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解
H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解
【解析】
(1)砷(AS)是第四周期ⅤA族元素,依据周期序数等于电子层数,最外层电子数等于主族序数,所以砷原子核外有4个电子层,最外层有5个电子;
故答案为:4;5;
(2)同主族元素原子从上到下原子半径依次增大,所以按从小到大的顺序排列N<P<As;
故答案为:N<P<As;
(3)溴与砷同周期,位于ⅧA族,同周期元素从左到右非金属性依次增强,溴、砷最高价氧化物对应水化物酸性的强弱HBrO4强于H3AsO4,
故答案为:HBrO4;H3AsO4;
(4)周期表中,铝和砷都在金属和非金属过渡线附近,具有非金属性:如氢氧化铝和碱溶液反应,氢氧化铝存在酸式电离,Al(OH)3![]() H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解,
H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解,
故答案为:氢氧化铝存在酸式电离,Al(OH)3![]() H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和,平衡向右移动,Al(OH)3溶解。
H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和,平衡向右移动,Al(OH)3溶解。

 作业辅导系列答案
作业辅导系列答案【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。