题目内容
【题目】将5.1g的氧化铝溶于一定浓度的500mL 的盐酸中,充分反应后,再逐滴加入0.5mol/L 的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
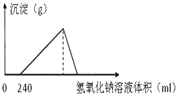
(1)最大沉淀的质量。_______
(2)沉淀最大时耗用多少毫升氢氧化钠溶液?______
(3)当沉淀从最大值到恰好完全消失时,耗用多少毫升的氢氧化钠溶液?______
(4)原盐酸溶液的物质的量浓度是多少?_____
【答案】7.8g 840mL 200mL 0.84mol/L
【解析】
从图中能得到的信息:盐酸溶解铝是过量的,所以加入氢氧化钠以后先中和过量的盐酸,然后才与铝离子沉淀;至氢氧化铝完全沉淀后,再溶解成NaAlO2,由此分析解答。
(1)根据铝守恒可知:Al2O32Al(OH)3
1022×78
5.1gm
所以![]() =
=![]() ,解之得:m=7.8g,
,解之得:m=7.8g,
答案为:7.8g;
(2) Al(OH)3的物质的量为![]() =0.1mol,铝离子和氢氧化钠溶液反应生成氢氧化铝沉淀的关系为:
=0.1mol,铝离子和氢氧化钠溶液反应生成氢氧化铝沉淀的关系为:
3NaOHAl(OH)3
3 1
n(NaOH)0.1 mol
解之得:n(NaOH)=0.3mol,
由图可知,中和盐酸消耗氢氧化钠溶液240mL,
沉淀最大时消耗NaOH为V=240mL+![]() ×103mL=840mL,
×103mL=840mL,
答案为:840mL;
(3)当沉淀从最大值到恰好完全消失时,根据反应:
Al(OH)3+NaOH=NaAlO2+2H2O
1 1
0.1 mol n(NaOH)
解之得:n(NaOH)=0.1mol
当沉淀从最大值到恰好完全消失时,耗用氢氧化钠溶液的体积为![]() =200mL,
=200mL,
答案为:200mL;
(4)最大沉淀时,溶液是单一溶质NaCl,此时n(HCl)=n(NaOH),c(HCl)=![]() =0.84mol/L,
=0.84mol/L,
答案为:0.84mol/L。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目