题目内容
【题目】某温度下,向一定体积0.1mol/L氨水中逐滴加入相同浓度的盐酸,溶液中pH与pOH的变化关系如图所示。下列说法错误的是( )

A.此温度下,水的离子积常数为1.0×10-2a
B.N点溶液加水稀释,![]() 增大
增大
C.M、Q、N三点所示的溶液中均存在:c(NH![]() )+c(H+)=c(OH-)+c(Cl-)
)+c(H+)=c(OH-)+c(Cl-)
D.Q点消耗的盐酸的体积等于氨水的体积
【答案】D
【解析】
A.Q点溶液中pOH=pH,c(H+)=c(OH-)=10-amol/L,溶液呈中性,此时氢离子浓度和氢氧根浓度乘积即为该温度下的离子积常数,为1.0×10-2a,故A正确;
B.一水合氨的电离平衡常数Kb=![]() ,所以
,所以![]() =
=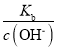 ,N点溶液pOH<pH,所以c(H+)<c(OH-),溶液显碱性,加水稀释溶液碱性减弱,所以c(OH-)减小,电离平衡常数不变,则
,N点溶液pOH<pH,所以c(H+)<c(OH-),溶液显碱性,加水稀释溶液碱性减弱,所以c(OH-)减小,电离平衡常数不变,则![]() 增大,故B正确;
增大,故B正确;
C.M、Q、N三点所示的溶液中均存在电荷守恒,即c(NH![]() )+c(H+)=c(OH-)+c(Cl-),故C正确;
)+c(H+)=c(OH-)+c(Cl-),故C正确;
D.氨水和盐酸浓度相同,若等体积混合,溶质为氯化铵,溶液显酸性,而Q点溶液呈中性,所以氨水的体积要稍大于盐酸的体积,故D错误;
故答案为D。

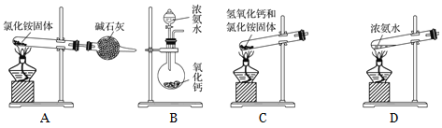
【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。