题目内容
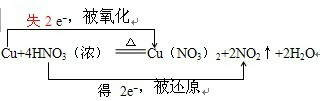
20.Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(1)浓盐酸在反应中显示出来的性质是B (填写字母).
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3mol Cl2,则转移的电子的物质的量为0.3 mol.
(3)此反应的离子反应方程式为ClO-+Cl-+2H+=Cl2↑+H2O.
(4)用双线桥法表示该氧化还原反应中电子转移的方向和数目
 .
.(5)配平方程式:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
分析 (1)根据氯元素的化合价变化来确定其性质;
(2)根据氯气和转移电子之间的关系式计算;
(3)改写方程式时Ca(ClO)2、HCl、CaCl2写成离子,其它保留化学式;
(4)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是2;
(5)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数.
解答 解:(1)该反应中,浓盐酸中的氯元素部分失去电子作还原剂,部分化合价不变,作酸,所以浓盐酸的性质是还原性和酸性,故选B;
(2)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以生成2mol氯气时其转移电子是2mol,故产生0.3molCl2,则转移的电子的物质的量为0.3mol,
故答案为:0.3mol;
(3)改写方程式时Ca(ClO)2、HCl、CaCl2写成离子,则其离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(4)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是2, ,
,
故答案为: ;
;
(5)反应中KMnO4+→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2;16;2;2;5;8.
点评 本题考查氧化还原反应,题目难度中等,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析.

| A. | 消耗1molA的同时消耗1mol B | B. | 消耗n molA,同时生成2nmolC | ||
| C. | 气体的总体积不变 | D. | 容器内气体密度不变 |
| A. | NH3溶于水所得溶液能导电,据此可判断NH3属于电解质 | |
| B. | 某气体只含 N、H 两种元素,且质量之比为 14:3,则该气体一定为纯净物 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 尽管 NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 |
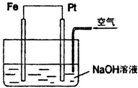
| A. | Fe是正极,Pt是负极 | B. | 该装置中,电子从Fe流向Pt | ||
| C. | 正极反应为:2H++2e-═H2↑ | D. | 负极反应为:4OH--4e-═2H2O+O2↑ |
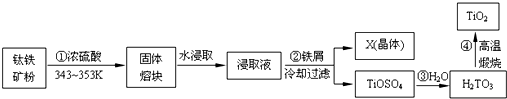
 .
.