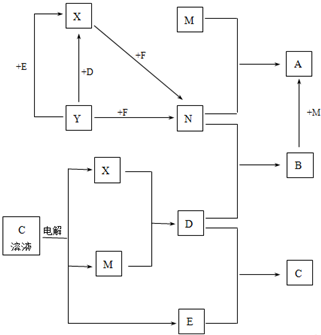
题目内容
9.0.2mol Na、Mg、A1分别与100mL 1mol/L的盐酸反应生成的H2在相同状况下的体积比为2:1:1.分析 钠与盐酸发生反应:2Na+2HCl=NaCl+H2↑,由于Na能与水反应生成NaOH与氢气,与盐酸反应时,Na会完全反应,根据2Na~H2↑计算生成氢气物质的量,而Mg、Al不能与水反应,与盐酸发生反应:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,进行过量计算,根据不足量的物质计算生成氢气物质的量,相同状况下,气体体积之比等于物质的量之比.
解答 解:钠与盐酸发生反应:2Na+2HCl=NaCl+H2↑,由于Na能与水反应生成NaOH与氢气,与盐酸反应时,Na会完全反应,根据2Na~H2↑,可知生成氢气物质的量为0.2mol×$\frac{1}{2}$=0.1mol;
HCl的物质的量为0.1L×1mol/L=0.1mol,
由Mg+2HCl=MgCl2+H2↑,可知0.2molMg完全反应消耗0.4molHCl>0.1mol,则HCl不足,故生成氢气为0.1mol×$\frac{1}{2}$=0.05mol;
由2Al+6HCl=2AlCl3+3H2↑,可知0.2molMg完全反应消耗0.6molHCl>0.1mol,则HCl不足,故生成氢气为0.1mol×$\frac{1}{2}$=0.05mol,
则Na、Mg、A1生成的H2在相同状况下的体积比为0.1mol:0.05mol:0.05mol=2:1:1,
故答案为:2:1:1.
点评 本题考查化学方程式计算,涉及过量计算,注意Na能与水反应生成氢气,难度不大.

练习册系列答案
相关题目
17.“高分八号”高分辨率对地观测系统光学遥感卫星在我国太原成功发射,如图示为某卫星的能量转 化示意图,其中燃料电池以 KOH 溶液为电解液,下列说法不正确的是( )
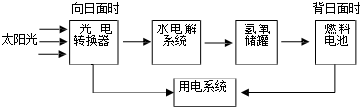

| A. | 整个系统实现了物质零排放及能量间的完全转化 | |
| B. | 燃料电池的负极反应式为 H2+2OH--2e-═2H2O | |
| C. | 水电解系统中加入 Na2SO4 可增加溶液导电性 | |
| D. | 该系统的总反应式为 2H2+O2$?_{充电}^{放电}$2H2O |
14.下列离子在溶液中可以大量共存的一组是( )
| A. | Mg2+、Na+、Cl-、OH- | B. | Na+、Ca2+、NO3-、CO32- | ||
| C. | K+、H+、Na+、HCO3- | D. | Na+、K+、NO3-、Cl- |
19.下列关于铝的叙述,不正确的是( )
| A. | 铝属于ⅢA族元素 | B. | 铝既能溶于酸,又能溶于强碱溶液 | ||
| C. | 在常温下,铝不能与氧气反应 | D. | 铝是地壳中含量最多的金属元素 |
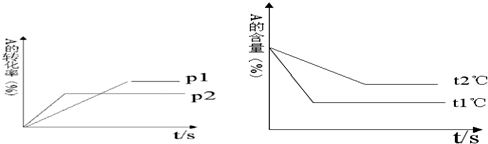
 Ⅰ时,反应物A的转化率a(A)=60%.x:y=1:2.
Ⅰ时,反应物A的转化率a(A)=60%.x:y=1:2. .
. 为了证明铜与稀硝酸反应产生一氧化氮,某校同学设计了一个 实验,其装置如图所示(加热装置和固定装置均已略去).
为了证明铜与稀硝酸反应产生一氧化氮,某校同学设计了一个 实验,其装置如图所示(加热装置和固定装置均已略去).