题目内容
10.二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下: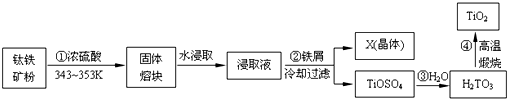
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O.
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,适宜的条件还可以选择熔块粉碎(或连续搅拌、适当升高温度等).
(3)浸取液与铁屑反应的离子方程式为2Fe3++Fe=3Fe2+;X(晶体)为绿矾(FeSO4•7H2O),配制、保存该溶液时需加少量铁屑,目的是防止Fe2+被氧化.
(4)过滤时所需玻璃仪器为漏斗、玻璃棒和烧杯.
(5)第③步反应化学方程式TiOSO4+2H2O=H2TiO3+H2SO4.
分析 钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)加入浓硫酸加热反应得到固体熔块,加入水水浸,得到浸取液中加入铁屑防止亚铁离子被氧化为铁离子,过滤得到X晶体为为绿矾(FeSO4•7H2O)晶体和滤液TiOSO4,加入水反应生成H2TiO3,高温煅烧得到二氧化钛.
(1)钛铁矿主要成分FeTiO3与浓硫酸反应的主要产物是TiOSO4和FeSO4,结合原子守恒配平书写化学方程式;
(2)为提高“固体熔块”水浸取时的浸出率可以连续搅拌,升高温度,循环浸取、延长时间、熔块粉碎等;
(3)亚铁离子易被空气中氧气氧化为铁离子,避免亚铁离子被氧化且不引入杂质,加入铁屑可以防止亚铁离子被氧化;
(4)根据过滤操作的原理、使用的仪器进行分析解答;
(5)第③步反应是TiOSO4加入水反应生成H2TiO3和硫酸的反应.
解答 解:钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)加入浓硫酸加热反应得到固体熔块,加入水水浸,得到浸取液中加入铁屑防止亚铁离子被氧化为铁离子,过滤得到X晶体为为绿矾(FeSO4•7H2O)晶体和滤液TiOSO4,加入水反应生成H2TiO3,高温煅烧得到二氧化钛.
(1)钛铁矿主要成分FeTiO3与浓硫酸反应的主要产物是TiOSO4和FeSO4,结合原子守恒配平书写化学方程式为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,
故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(2)为提高“固体熔块”水浸取时的浸出率,适宜的条件可以选择,连续搅拌能加快水分子运动速度,升高温度,循环浸取、延长时间、熔块粉碎等,
故答案为:熔块粉碎(或连续搅拌、适当升高温度等);
(3)亚铁离子易被空气中氧气氧化为铁离子,避免亚铁离子被氧化且不引入杂质,加入铁屑可以防止亚铁离子被氧化,2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;防止Fe2+被氧化;
(4)过滤中用到的仪器有:铁架台、玻璃棒、烧杯、漏斗等,其中用到的三种玻璃仪器是漏斗、烧杯、玻璃棒;烧杯用来盛放液体,漏斗用于过滤,玻璃棒用来引流和搅拌,
故答案为:漏斗;玻璃棒;
(5)第③步反应是TiOSO4加入水反应生成H2TiO3和硫酸的反应 的化学方程式为:TiOSO4+2H2O=H2TiO3+H2SO4,
故答案为:TiOSO4+2H2O=H2TiO3+H2SO4.
点评 本题考查了硫酸法制取二氧化钛实验,涉及物质提纯、分离、制备等流程分析判断,把握物质的性质、反应原理、实验技能为解答的关键,题目难度中等.

| A. | 含有3个甲基 | B. | 一氯代物只有一种 | ||
| C. | 使溴水褪色 | D. | 四个碳原子共平面 |

| A. | 该反应的化学方程式为:X+Y?2Z | |
| B. | 当反应速率大小关系为:v(X)=v(Y)=2v(Z)时,该反应达到平衡状态 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 该反应的正反应是放热反应 |
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:



 Ⅰ时,反应物A的转化率a(A)=60%.x:y=1:2.
Ⅰ时,反应物A的转化率a(A)=60%.x:y=1:2. .
.