题目内容
12.下列推断正确的是( )| A. | NH3溶于水所得溶液能导电,据此可判断NH3属于电解质 | |
| B. | 某气体只含 N、H 两种元素,且质量之比为 14:3,则该气体一定为纯净物 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 尽管 NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 |
分析 A、溶于水或熔融状态导电的化合物为电解质,化合物能本身电离出离子的化合物为电解质;
B、某气体只含N、H 两种元素,且质量之比为14:3可能是NH3,也可能是N2和H2的混合气体;
C、离子反应一定要在溶液中发生,故氨气和氯化氢气体的反应不是离子反应;
D、没有一种含N的酸中的N的化合价与NO2相同,NO2不属于酸性氧化物.
解答 解:A、溶于水或熔融状态导电的化合物为电解质,化合物能本身电离出离子的化合物为电解质,NH3溶于水所得溶液能导电是因为氨气和水反应生成了电解质,本身不能电离出离子属于非电解质,故A错误;
B、某气体只含N、H 两种元素,且质量之比为14:3,物质的量之比=$\frac{14}{14}$:$\frac{3}{1}$=1:3可能是NH3,也可能是N2和H2的混合气体,故B错误;
C、离子反应一定要在溶液中发生,故氨气和氯化氢气体的反应是气体反应不是离子反应,故C错误;
D、NO2能与水反应生成硝酸是发生的氧化还原反应,没有一种含N的酸中的N的化合价与NO2相同,NO2不属于酸性氧化物,故D正确;
故选D.
点评 本题考查了物质分类方法,物质组成特点,主要是酸性氧化物、离子反应的分析判断,掌握实质是关键,题目较简单.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
7.下列溶液一定呈酸性的是( )
| A. | pH=6.8的溶液 | |
| B. | 常温下,由水电离的OH-离子浓度为1×10-13 mol/L | |
| C. | 加入酚酞,不显红色的溶液 | |
| D. | 常温下,溶液中的H+离子浓度为5×10-7 mol/L |
17.“高分八号”高分辨率对地观测系统光学遥感卫星在我国太原成功发射,如图示为某卫星的能量转 化示意图,其中燃料电池以 KOH 溶液为电解液,下列说法不正确的是( )
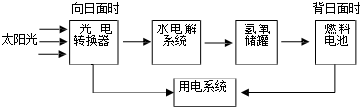

| A. | 整个系统实现了物质零排放及能量间的完全转化 | |
| B. | 燃料电池的负极反应式为 H2+2OH--2e-═2H2O | |
| C. | 水电解系统中加入 Na2SO4 可增加溶液导电性 | |
| D. | 该系统的总反应式为 2H2+O2$?_{充电}^{放电}$2H2O |
2.下列叙述正确的是( )
| A. | 不能跟酸反应的氧化物一定能跟碱反应 | |
| B. | 同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高 | |
| C. | 在CCl4、PCl3、HCl中各原子最外层均能达到8电子稳定结构 | |
| D. | 升高温度可以加快反应速率,其主要原因是反应物分子能量增加,活化分子百分数的增加,使有效碰撞次数增加 |
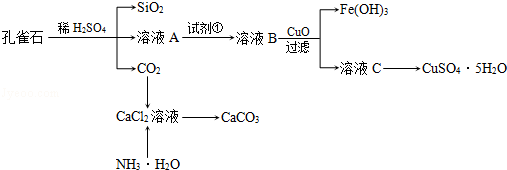
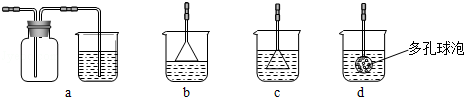
 .
. 为了证明铜与稀硝酸反应产生一氧化氮,某校同学设计了一个 实验,其装置如图所示(加热装置和固定装置均已略去).
为了证明铜与稀硝酸反应产生一氧化氮,某校同学设计了一个 实验,其装置如图所示(加热装置和固定装置均已略去).