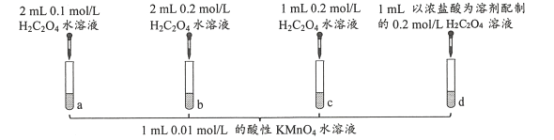
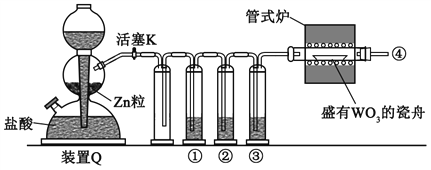
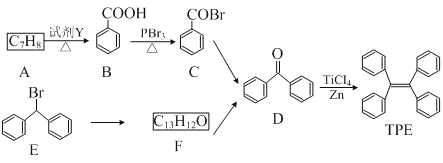
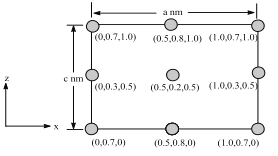
题目内容
【题目】常温下,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,测得混合溶液的BG(BG=-lg![]() )与所加NaOH的体积的变化关系如图所示。
)与所加NaOH的体积的变化关系如图所示。
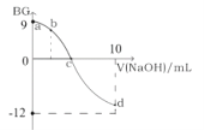
下列叙述错误的是( )
A.该滴定过程可选用酚酞做指示剂
B.c点所加的NaOH溶液的体积小于5mL
C.从a点到c点,水的电离程度一直增大
D.若b点所加的NaOH溶液的体积等于2.5mL,则所得溶液中:c(H+)=c(HA)+c(OH)+c(Na+)
【答案】D
【解析】
A.常温下,0.1molL1的一元酸HA溶液的BG=9,即![]() =10-9,由水的离子积常数知c(H+)×c(OH-)=10-14,解得c(H+)=1.0×10-2.5molL1<0.1molL1,故一元酸HA为弱酸,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,滴定终点生成的强碱弱酸盐,所以选择酚酞作指示剂,A正确;
=10-9,由水的离子积常数知c(H+)×c(OH-)=10-14,解得c(H+)=1.0×10-2.5molL1<0.1molL1,故一元酸HA为弱酸,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,滴定终点生成的强碱弱酸盐,所以选择酚酞作指示剂,A正确;
B.c点时BG=0,则溶液中c(H+)=c(OH-),溶液呈中性,如果加入的0.1molL1的NaOH溶液的体积为5mL,恰好与5mL0.1molL1的一元酸HA溶液完全反应生成NaA,NaA为强碱弱酸盐,溶液呈碱性,故c点所加的NaOH溶液的体积小于5mL,B正确;
C.从a点到c点,随着NaOH溶液不断加入,HA的量不断减小,对水的电离的抑制作用不断减小,故从a点到c点,水的电离程度一直增大,C正确;
D.若b点所加的NaOH溶液的体积等于2.5mL,c(HA)=c(NaA),因为HA是弱酸,所以c(H+)<c(Na+),故c(H+)<c(HA)+c(OH)+c(Na+),D错误;
答案选D。

练习册系列答案
相关题目