题目内容
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
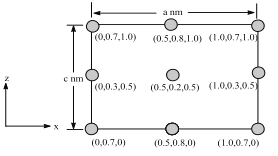
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
【答案】> 镁原子的价电子排布为3s2,处于全充满状态,比较稳定,失去电子较难 离子键、非极性共价键、极性共价键(或离子键、共价键) d 3d64s2 5 二者都是离子晶体,O2-与S2-所带的电荷相同,但O2-半径小于S2-,Cu2O的晶格能大于Cu2S 三角锥形 sp3 A 4 ![]()
【解析】
前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6,令A的最外层电子数为x,则2+8+x=6x,x=2,故A为Mg;B元素核外只有一个未成对电子,能与水剧烈反应,B为K;C元素正三价离子的3d轨道为半充满状态,C为Fe;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子D为Cu;E元素的价电子构型为nsanpa+1,s能级最多有2个电子,故a=2,所以E元素的价电子构型为ns2np3,E为第ⅤA族元素,其某种氧化物有剧毒,E为As。
(1)同周期第ⅡA族元素的第一电离能大于第ⅢA族元素的第一电离能;
(2)K2O2与H2O反应的化学方程式为2 K2O2+2H2O= O2↑+2KOH,从K2O2与H2O反应的化学方程式中判断反应过程中断裂的化学键的种类;
(3)依据Fe元素的原子序数,以及基态原子核外电子排布式判断Fe元素位于元素周期表的哪个区;
(4)利用影响晶格能大小的因素比较Cu2O、Cu2S熔点的高低;
(5)计算出AsCl3的价层电子对数、中心原子的孤电子对数,判断出分子构型依及中心原子的杂化类型;
(6)先分析得出K原子的个数,再根据公式计算密度。
由分析知A为Mg、B为K、C为Fe、D为Cu、E为As。
(1)镁原子的价电子排布为3s2,处于全充满状态,比较稳定,失去电子较难,故Mg元素的第一电离能大于Al元素的第一电离能;
(2)B2O2为K2O2,其与H2O反应的化学方程式为2 K2O2+2H2O= O2↑+2KOH,该反应过程中断裂的化学键为离子键、非极性共价键、极性共价键(或离子键、共价键);
(3)C元素为Fe,原子序数为26,位于元素周期表的d区,它的基态原子核外电子排布式为[Ar]3d64s2,故其价电子排布式是3d64s2;Fe(CO)x的中心原子价电子数与配位数提供的电子数之和为18,Fe(CO)x中一个CO提供2个电子,与Fe形成一个配位键,8+2x=18,x=5;
(4)Cu2O与Cu2S二者都是离子晶体,O2-与S2-所带的电荷相同,但O2-半径小于S2-,Cu2O的晶格能大于Cu2S ,故Cu2O的熔点比Cu2S的熔点高;
(5)AsCl3的价层电子对数为4,中心原子As有1对孤电子对,其分子的立体构型为三角锥形,其中As的杂化类型为sp3;As在周期表中位于金属与非金属交界处,故As的单质可作为半导体材料,A正确;同主族从上到下,随着核电荷数的增加,电负性逐渐减小,As的电负性小于P的电负性,B错误;H3AsO4为弱酸,C错误;
(6)KSiAl3O7属于正交晶系(长方体形),原子分数坐标为(0.5,0.2,0.5)的K原子位于体内,原子分数坐标为(0,0.3,0.5)及 (1.0,0.3,0.5) 的K原子分别位于晶胞的左侧面、右侧面,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的K原子分别位于晶胞的上底面、下底面,原子分数坐标为(0,0.7,1.0)、(1.0,0.7,1.0)、(0,0.7,0)及(1.0,0.7,0) 的K原子位于晶胞平行于y轴的棱上,则晶胞中K原子的数目为:1+4×![]() +4×
+4×![]() ,由化学式KSiAl3O7,可知晶胞中相当于含有4个“KSiAl3O7”,令晶胞的密度为
,由化学式KSiAl3O7,可知晶胞中相当于含有4个“KSiAl3O7”,令晶胞的密度为![]() ,则(a×10-7)×(b×10-7)×
,则(a×10-7)×(b×10-7)×
(c×10-7)×![]() ×NA=4M,解得
×NA=4M,解得![]() =
=![]() (gcm3)。
(gcm3)。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D