题目内容
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。Al+NO3-+ —AlO2-+N2↑+H2O,_____________
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
【答案】![]() 1.5 1:2:2:1 10Al+6NO3-+4 OH- = 10 AlO2-+3 N2↑+2 H2O I2、KIO3
1.5 1:2:2:1 10Al+6NO3-+4 OH- = 10 AlO2-+3 N2↑+2 H2O I2、KIO3 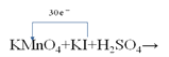
【解析】
(1)根据SO42-+Ba2+═BaSO4↓计算溶液中的Ba2+离子的物质的量,根据Ag++Cl-=AgCl↓算Cl-的物质的量,再根据c=![]() 计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度;
计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度;
(2)根据氧化还原反应中得失电子数目相等分析解答;
(3)用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价升至0价,而用过氧化氢和过氧化钠制氧气,O则由-1价升至0价。据此分析解答;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价, NO3-→N2↑,氮元素化合价由+5价降低为0价,根据化合价升降守恒,结合电荷守恒、原子守恒配平方程式;
(5)反应KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素化合价降低,由+7价降低到+2价,被还原,KMnO4为氧化剂,I元素化合价升高,由-1价升高到0价和+5价,KI为还原剂,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等分析解答。
(1)BaCl2和KCl的混合溶液V L,将它均分成两份。
一份滴加稀硫酸,使Ba2+完全沉淀,消耗a molH2SO4,由 SO42-+Ba2+═BaSO4↓,可知n(Ba2+)=n( SO42-)=n(H2SO4)=amol,则c(Ba2+)=![]() =
=![]() mol/L;
mol/L;
另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗bmolAgNO3,由 Ag++Cl-=AgCl↓,可知n(Cl-)=n(Ag+)=n(AgNO3)=b mol,则c(Cl-)=![]() =
=![]() mol/L;
mol/L;
溶液显电中性,由电荷守恒可知,c(K+)+![]() mol/L×2=
mol/L×2=![]() mol/L,解得:c(K+)=
mol/L,解得:c(K+)=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L。
mol/L。
(2)利用电子守恒,当1molCr3+被氧化为Cr2O72-(0.5mol)时,所失去的电子数为3mol,这些电子被PbO2得到,而1mol PbO2被还原只得到2mol电子,因此需要PbO2的物质的量为1.5mol,故答案为:1.5 mol。
(3)用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价升至0价,如生成1mol O2,需转移4mol电子,而用过氧化氢和过氧化钠制氧气,O则由-1价升至0价,如生成1mol O2,需转移2mol电子,当制得同温同压下相同体积的氧气时,过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气的四个反应中转移的电子数之比为1∶2∶2∶1,故答案为:1∶2∶2∶1;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知NO3-系数为6,由Al元素守恒可知AlO2-系数为10,根据碱性条件,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O系数为2,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,故答案为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;
(5)①反应中I元素化合价升高,由-1价升高到0价和+5价,KI为还原剂,则氧化产物为I2和KIO3,故答案为:I2、KIO3;
②该反应方程式中I2和KIO3的计量数分别是是6和3,则I元素失去电子的数目为2×6×[0-(-1)]+3×[+5-(-1)]=30,电子转移方向和数目可表示为![]() ,故答案为:
,故答案为:![]() 。
。