题目内容
16.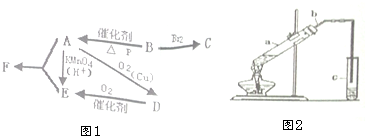 有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:
有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:(1)E分子中官能团是羧基;
(2)B→C的反应类型加成反应;
(3)由A到D分两步完成,已知第一步反应方程式为2Cu+O$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;则第二步反应的化学方程式是CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O;
(4)在实验室用图2所示的装置制取F,先在试管a中放入几块碎瓷片,然后加入2mL无水A液体,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后,将试管固定在铁架台上,在试管C中加入5mL饱和分碳酸钠溶液,按图连接好装置,用酒精灯对试管a小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.
①试管a中加入几块碎瓷片的目的是防止溶液暴沸;
②该实验中长导管b的作用是导气、冷凝;
③试管c中饱和NaCO3的作用是除去乙酸乙酯中的乙醇和乙酸并降低乙酸乙酯的溶解度;
④写出试管a中发生的总反应的化学方程式2CH3COONa+2CH3CH2OH+H2SO4$\stackrel{△}{→}$2CH3COOCH2CH3+2H2O+Na2SO4.
分析 B是石油化工发展水平的标志,则B是乙烯其结构简式为CH2=CH2,B和Br2发生加成反应生成C,结构简式为CH2BrCH2Br,A能发生两步氧化,A仅由C、H、O三种元素组成,所以A结构简式为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成乙酸,所以E结构简式为CH3COOH,乙醇被氧化生成D、D被氧化生成E,所以D结构简式为CH3CHO,乙醇和乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,所以F结构简式为CH3COOCH2CH3,据此分析解答.
解答 解:B是石油化工发展水平的标志,则B是乙烯其结构简式为CH2=CH2,B和Br2发生加成反应生成C,结构简式为CH2BrCH2Br,A能发生两步氧化,A仅由C、H、O三种元素组成,所以A结构简式为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成乙酸,所以E结构简式为CH3COOH,乙醇被氧化生成D、D被氧化生成E,所以D结构简式为CH3CHO,乙醇和乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,所以F结构简式为CH3COOCH2CH3,
(1)E结构简式为CH3COOH,E分子中官能团是羧基,故答案为:羧基;
(2)根据上面的分析可知,B→C的反应类型是加成反应,故答案为:加成反应;
(3)由A到D分两步完成,已知第一步反应方程式为2Cu+O$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;则第二步反应的化学方程式是CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,
故答案为:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O;
(4)在实验室制取CH3COOCH2CH3的实验中,①试管a中加入几块碎瓷片的目的是防止溶液暴沸,②该实验中长导管b的作用是导气、冷凝,③试管c中饱和NaCO3的作用是除去乙酸乙酯中的乙醇和乙酸并降低乙酸乙酯的溶解度,④试管a中乙酸钠与硫酸反应生成乙酸,乙酸与乙醇在浓硫酸作用下加热生成乙酸乙酯,发生的总反应的化学方程式为2CH3COONa+2CH3CH2OH+H2SO4$\stackrel{△}{→}$2CH3COOCH2CH3+2H2O+Na2SO4,
故答案为:防止溶液暴沸;导气、冷凝;降低乙酸乙酯的溶解度;2CH3COONa+2CH3CH2OH+H2SO4$\stackrel{△}{→}$2CH3COOCH2CH3+2H2O+Na2SO4.
点评 本题考查有机物推断,涉及烯、醇、醛、羧酸、卤代烃之间的转化以及实验室乙酸乙酯的制备,明确物质官能团及其性质之间的关系以及相关实验基本操作即可解答,熟练掌握有机物反应类型,题目难度不大.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |
| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
| A. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | NaHCO3溶液与氢氧化钠溶液反应:HCO3-+2OH-═CO2↑+H2O | |
| C. | 用CH3COOH 溶液CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H20═Al(OH)3↓+HCO3- |
| A. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| B. | 气态单质分子中一定存在共价键 | |
| C. | 氢元素即可与氯元素形成共价键也可与钠元素形成离子键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
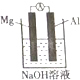 (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系). | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发生“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变为浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应开始不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶装沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填1-F) | B |
(3)该同学又想起老师曾说过:构成原电池时一般来说活泼性强的金属做负极,于是他设计如图所示原电池装置,认为Mg做负极,Al做正极,可是实验结果却是在Mg上看到了气体,于是向老师求解才知影响铝在原电池中做正极或负极的因素之一是:电解质溶液的酸碱性,而此装置中负极发生的电极反应式为Al3+-3e-+4OH-=AlO2-+2H2O.
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
 、
、 ;
; ;
;