题目内容
11.下列递变规律正确的是( )| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | P、S、Cl最高正价依次降低 | |
| C. | HCl、HBr、HI的稳定性依次增强 | |
| D. | 钠、镁、铝的金属性依次减弱 |
分析 A.非金属性越强,最高价氧化物的水化物酸性最强;
B.P、S、Cl最高正价均等于最外层电子数;
C.非金属性越强,气态氢化物的稳定性越强;
D.钠、镁、铝同周期,原子序数大的金属性弱.
解答 解:A.非金属性Cl>S>P,HClO4、H2SO4、H3PO4的酸性依次减弱,故A错误;
B.P、S、Cl最高正价均等于最外层电子数,分别为+5、+6、+7,依次增大,故B错误;
C.非金属性Cl>Br>I,HCl、HBr、HI的稳定性依次减弱,故C错误;
D.钠、镁、铝同周期,原子序数大的金属性弱,还原性也弱,则钠、镁、铝的还原性依次减弱,故D正确;故选D.
点评 本题考查元素周期表和元素周期律,为高频考点,把握同周期和同主族元素的性质变化规律、金属性与非金属性强弱的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
1.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
2.硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3 将2molSO22mol O2加入容积为5L的带有活塞的密闭器中,在一定条件下达到平衡.不同温度下,反应的平衡常数如右表,且在温度为T1、T2时,平衡体系中SO2的体积分数随压强变化曲线如图1所示.
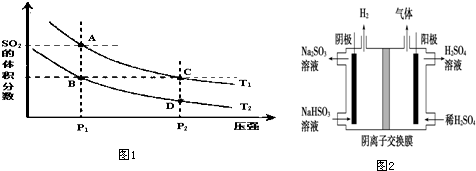
(1)比较K值的大小,K1<K2(填>、=、<).
(2)下列说法正确的是CD
A.A、C两点的正反应速率:A>C
B.A、C两点SO2气体的浓度:A>C
C.B、C两点的气体的平均相对分子质量:B=C
D.由状态D到状态C,可以用加热的方法
(3)在500℃时,若保持容积不变,每隔一定时间就对该容器内的物质进行分析,得到如下表的部分数据:
①在上述条件下,从反应开始直至60s时,二氧化硫的平均反应速率为0.0006mol•(L•s)-1.
②该条件下反应的平衡常数K的值为368.2(精确到小数点后一位).
(4)工业上用Na2SO3吸收尾气中的SO2使之转化为NaHSO3,再用图2装置电解(惰性电极)NaHSO3制取H2SO4,该电解池阴极的总电极反应式2HSO3-+2e-═SO32-+H2↑,阳极室除生成硫酸外,还有少量的SO2 和O2生成.则阳极发生的副反应的电极反应式为2SO32-+4e-═2SO2↑+O2↑,该工艺中可循环利用的物质是Na2SO3、H2SO4、SO2(填化学式).

(1)比较K值的大小,K1<K2(填>、=、<).
(2)下列说法正确的是CD
A.A、C两点的正反应速率:A>C
B.A、C两点SO2气体的浓度:A>C
C.B、C两点的气体的平均相对分子质量:B=C
D.由状态D到状态C,可以用加热的方法
(3)在500℃时,若保持容积不变,每隔一定时间就对该容器内的物质进行分析,得到如下表的部分数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(SO2)/mol | 2.00 | 0.60 | |||
| n(SO3)/mol | 0.00 | 0.80 | 1.8 | 1.8 |
②该条件下反应的平衡常数K的值为368.2(精确到小数点后一位).
(4)工业上用Na2SO3吸收尾气中的SO2使之转化为NaHSO3,再用图2装置电解(惰性电极)NaHSO3制取H2SO4,该电解池阴极的总电极反应式2HSO3-+2e-═SO32-+H2↑,阳极室除生成硫酸外,还有少量的SO2 和O2生成.则阳极发生的副反应的电极反应式为2SO32-+4e-═2SO2↑+O2↑,该工艺中可循环利用的物质是Na2SO3、H2SO4、SO2(填化学式).
19.有一澄清透明的溶液可能含有H+、AlO2-、CO32-、Cl-、NO3-、Ag+、Fe3+、Fe2+、Al3+、NH4+十种离子中的几种,向溶液中逐滴加入一定量1mol•L-1 NaOH溶液,开始产生沉淀并逐渐增多,随后又逐渐减少,整个过程始终无气体放出.则下列判断正确的是( )
| A. | 可能含有Ag+、Al3+、NH4+ | B. | 一定不含Cl-,可能含有NO3- | ||
| C. | 一定不含NH4+、AlO2-、CO32- | D. | 可能含有Fe3+,一定不含Fe2+ |
6.100℃时,水的离子积为5.5×10-13,则此温度时纯水呈( )
| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |
16.在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最大的是( )
| A. | v(A2)=0.8mol•L-1•s-1 | B. | v(A2)=60mol•L-1•min-1 | ||
| C. | v(AB3)=1.0mol•L-1•s-1 | D. | v(B2)=1.2mol•L-1•s-1 |
3.下列各表述与示意图一致的是( )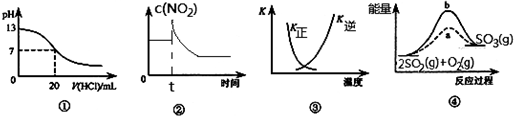

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
1.下列说法不正确的是( )
| A. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| B. | 气态单质分子中一定存在共价键 | |
| C. | 氢元素即可与氯元素形成共价键也可与钠元素形成离子键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
 溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下: