题目内容
18.下列说法正确的是( )| A. | 分子晶体中都存在共价键 | B. | 在单质的晶体中一定不存在阴离子 | ||
| C. | 离子晶体中只有离子键 | D. | 干冰和冰中作用力完全相同 |
分析 A.单原子分子晶体中不存在共价键,只有分子间作用力;
B.由阴离子和阳离子构成的物质属于离子化合物;
C.离子晶体中一定含有离子键,可能含有共价键;
D.冰中分子间有氢键.
解答 解:A.稀有气体中不存在共价键,只有分子间作用力,故A错误;
B.由阴离子和阳离子构成的物质属于离子化合物,则含有阴离子的一定是离子化合物,所以在单质的晶体中一定不存在阴离子,故B正确;
C.离子晶体中一定含有离子键,可能含有共价键,如NaOH中含有离子键和共价键,属于离子化合物,故C错误;
D.干冰分子间只有范德华力,冰中分子间有范德华力和氢键,故D错误;
故选:B.
点评 本题考查了化学键、晶体的组成和性质,题目难度不大,本题注意相关基础知识的积累.

练习册系列答案
相关题目
8.某单烯烃与H2加成后的产物是: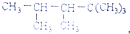 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
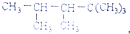 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 2种 |
9.下列与有机物的结构、性质有关的叙述不正确的是( )
| A. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| B. | C5H12有3种同分异构体 | |
| C. | 氨基酸、淀粉均属于高分子化合物 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |
6.100℃时,水的离子积为5.5×10-13,则此温度时纯水呈( )
| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |
13.目前有部分学生在做作业或考试时,喜欢使用修正液(涂改液),经实验证明,修正液中含有多种挥发性有害物质,吸人后易引起头晕、头痛、严重者会呼吸困难、抽搐.三氯乙烷(CH3CCl3)就是其中的一种.下面关于三氯乙烷的几种叙述正确的是( )
| A. | 由碳、氢、氯三种元素组成的化合物 | |
| B. | 它的分子中碳、氢、氯元素的原子个数比为1:3:3 | |
| C. | 它的相对分子质量为CH4的6倍 | |
| D. | 它是冰箱中常用的制冷剂 |
3.下列各表述与示意图一致的是( )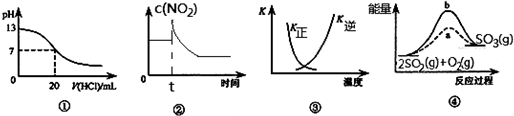

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
10.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且含锰元素的化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.336L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,充分反应后生成氯气的体积是(气体体积都在标准状况下测定)( )
| A. | 1.344L | B. | 1.568L | C. | 1.792L | D. | 2.016L |
8. (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告:
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
(2)实验结论:同周期从左至右元素金属性减弱,非金属性增强 (或金属性Na>Mg>Al;非金属性Cl>S).
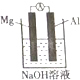
(3)该同学又想起老师曾说过:构成原电池时一般来说活泼性强的金属做负极,于是他设计如图所示原电池装置,认为Mg做负极,Al做正极,可是实验结果却是在Mg上看到了气体,于是向老师求解才知影响铝在原电池中做正极或负极的因素之一是:电解质溶液的酸碱性,而此装置中负极发生的电极反应式为Al3+-3e-+4OH-=AlO2-+2H2O.
 (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系). | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发生“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变为浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应开始不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶装沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填1-F) | B |
(3)该同学又想起老师曾说过:构成原电池时一般来说活泼性强的金属做负极,于是他设计如图所示原电池装置,认为Mg做负极,Al做正极,可是实验结果却是在Mg上看到了气体,于是向老师求解才知影响铝在原电池中做正极或负极的因素之一是:电解质溶液的酸碱性,而此装置中负极发生的电极反应式为Al3+-3e-+4OH-=AlO2-+2H2O.
 、
、 ;
; ;
;