题目内容
16.下列说法正确的是( )| A. | NaHCO3 是强电解质,BaCO3 是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.05 mol•L-1醋酸溶液加水稀释时,c(H+)变小 |
分析 A.绝大多数的盐属于强电解质;
B.氢离子浓度等于氢氧根离子浓度,溶液一定呈中性;
C.硫酸铝加热蒸干,仍然得到硫酸铝;
D.稀释酸性溶液,溶液中氢离子浓度减小.
解答 解:A、NaHCO3和BaCO3均属于盐,是强电解质,故A错误;
B、(H+)=10-7mol•L-1的溶液,溶液的pH=7,若温度为100℃,此时的溶液呈碱性,故B错误;
C、氯化铝为强酸弱碱盐,水解出Al(OH)3和HCl:AlCl3+3H2O?Al(OH)3+HCl,而HCl是挥发性酸,受热挥发会导致水解平衡右移,导致AlCl3彻底水解为Al(OH)3,灼烧时Al(OH)3又会分解为Al2O3,故将氯化铝溶液蒸干并灼烧得到的固体物质是Al2O3;Al2(SO4)3是强酸弱碱盐,水解出H2SO4和Al(OH)3,而H2SO4是不挥发性酸,受热不能挥发,即Al2(SO4)3的水解不能彻底,故最终得到的即为Al2(SO4)3,故C错误;
D、将酸性溶液稀释,氢离子浓度减小,故D正确,
故选D.
点评 本题考查了盐类水解的应用,难度不大,理解并加强记忆是掌握本类题型的关键.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
13.木糖醇是一种新型的甜味剂,是一种理想的蔗糖代替品,它具有甜味适中,溶解性好,适合糖尿病患者等优点,结构简式为:CH2OH(CHOH)3CH2OH.下列有关木糖醇的叙述正确的是( )
| A. | 木糖醇与核糖(C3H10O3)互为同分异构体 | |
| B. | 木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 | |
| C. | 木糖醇可以与乙酸发生酯化反应 | |
| D. | 木糖醇与葡萄一样是一种单糖 |
11.一定温度下,固定容器的密闭容器中进行的可逆反应:A(g)+B(g)═C(g)+D(g),当下列物理量不再改变时,表明反应已达到平衡的是( )
| A. | 单位时间内有1mol A生成,有1molC消耗 | |
| B. | 混合气体的密度不变 | |
| C. | A的消耗速率与D的消耗速率相同 | |
| D. | B物质的相对分子质量不变 |
1.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
8.某单烯烃与H2加成后的产物是: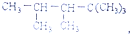 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
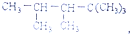 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 2种 |
5.以0.10mol/L的氢氧化钠溶液滴定某一元弱酸HA的滴定曲线如图所示.下列表述正确的是( )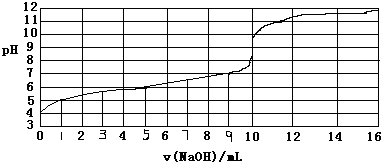

| A. | 此实验可以选用酚酞作指示剂 | |
| B. | 弱酸HA的浓度约为1×10-4mol/L | |
| C. | 根据已知条件,弱酸HA的电离常数(Ka)不能计算 | |
| D. | 当NaOH体积为9ml时,恰好完全中和反应 |
6.100℃时,水的离子积为5.5×10-13,则此温度时纯水呈( )
| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |