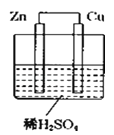
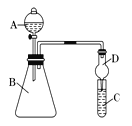
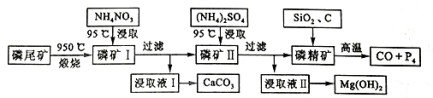
题目内容
【题目】在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
【答案】C
【解析】
试题分析:
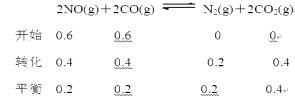
达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将增大,故A错误;反应前10秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1,反应前5秒钟内,用CO表示的平均反应速率大于0.04 mol·L-1·s-1,故B错误;当v正(CO)=2v逆(N2)时,反应达到平衡状态,该反应中NO的物质的量不再改变,故C正确;保持压强不变,往容器中充入1 mol He,体积增大,反应物浓度减小,正、逆反应速率都减小,故D错误。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
| IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ||||||
请按要求回答下列问题:
(1)元素③的最高价氧化物对应的水化物的化学式为 ;
(2)②、③两元素的原子半径较大的是______________(填元素符号);
(3)④和⑤两种元素的金属性较强的是 (填元素符号);
(4)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 。