题目内容
【题目】Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.

(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈, ________与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为__________.
Ⅱ.利用右图装置可验证同主族元素非金属性的变化规律
(3)干燥管D的作用是 .
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象, 即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液 的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶.
【答案】Ⅰ(1)钠 铝(2)S2-+Cl2=== S↓+2Cl-
Ⅱ(3) 防止溶液倒吸(4)变蓝 NaO (5)有白色沉淀生成 饱和NaHCO3溶液
【解析】试题分析:Ⅰ.(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:钠与盐酸反应最剧烈;1mol钠与盐酸反应生成0.5mol氢气,1mol镁与盐酸反应生成1mol氢气,1mol铝与盐酸反应产生1.5mol氢气,因此铝与盐酸反应产生的气体最多;(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:S2-+Cl2=== S↓+2Cl-;
Ⅱ.(3)干燥管D的作用是防止倒吸;(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝色,即可证明非金属性Cl>I;从环境保护观点考虑,此装置缺少尾气处理装置,可用NaOH溶液吸收尾气;(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液有白色沉淀产生,即可证明非金属性:C>Si;但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有饱和NaHCO3溶液的洗气瓶,以除去CO2气体中混有的HCl气体。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】有同学探究了三价铁离子在水溶液中的一些反应:
I、甲组同学将氯化铁溶液滴加到碘化钾溶液中,发现溶液的颜色变为浅绿色,请写出此反应的离子方程式 。同学们经过测定、查阅资料得出了以下结论:正向反应速率和I-、Fe3+的浓度关系为υ=k[I-]m[Fe3+]n(k为常数)
[I-](mol·L-1) | [Fe3+ ]( mol·L-1) | υmol·L-1·s-1) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
通过所给数据计算得知:
(1)在υ=k[I-]m[Fe3+]n中,m、n的值为m=_________,n=_________。
(2)碘离子浓度对反应速率的影响___________铁离子浓度对反应速率的影响。(选填:小于、大于、等于)。
II、乙组同学将硫氰化钾溶液滴入至氯化铁溶液中,得到了红色液体。
(1)在溶液中加入硫氰化钾粉末少量,颜色将 (填“变深”、“变浅”、“无明显现象”)。
(2)在溶液中加入氯化钾粉末少量,颜色将 (填“变深”、“变浅”、“无明显现象”)。
请用离子方程式解释原因: 。
【题目】某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品, 经了解其来源并查阅相关资料(如下表),初步确认为铜制品。
紫铜 | 青铜 | 铜绿 | |
主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
性质与用途 | 紫红色, 质软,导电性能良好;主要用作电线电缆。 | 多呈灰绿色, 熔点低、硬度大、 可塑性强;可铸造成各种器具。 | 不溶于水的灰绿色粉末,溶于酸, 加热易分解;可作颜料、杀虫剂。 |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3 ];
除上述猜想外,其他合理的猜想是____________________(只写一个)。
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是________________________。
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是__________________。
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3 ]。于是按图5所示装置进行实验。
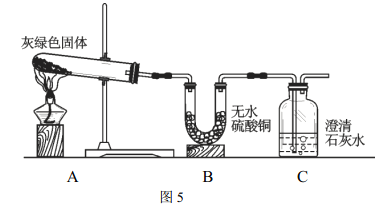
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了___________的现象, C中观察到了_____________的现象。B中所发生反应的化学方程式为:__________________。
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是______________。
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:___________________________。


