题目内容
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g) ![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了![]() 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
【答案】(1)CO2
(2)漏斗、烧杯、玻璃棒
(3)NH4+ 水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+
(4)MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4
(5)Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) ΔH =-418kJ/mol
(6)![]()
【解析】(1)根据题给化学工艺流程和信息①知磷尾矿[主要含Ca5(PO4)3F和CaCO3·MgCO3 ]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2)。
(2)实验室过滤所需的玻璃仪器是烧杯、漏斗和玻璃棒。
(3)NH4NO3溶液中铵离子水解呈酸性,与CaO、Ca(OH)2反应生成Ca2+。
(4)根据化学工艺流程判断浸取液II的主要成分为硫酸镁溶液,通入NH3,发生反应的化学方程式是MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4 。
(5)已知25℃,101kPa时:
①CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH =-271kJ/mol
②5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH =-937kJ/mol
根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) ΔH =-418kJ/mol 。
(6)根据题给数据利用三段式分析。设CO的起始浓度为1 mol/L,则水蒸气的起始浓度为5 mol/L
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)1 5 0 0
转化浓度(mol/L)5/6 5/6 5/6 5/6
平衡浓度(mol/L)1/6 25/6 5/6 5/6
则K=c(CO2)c(H2)/c(CO)c(H2O)=1。相同条件下当CO与H2O(g)的起始物质的量之比为1:3,平衡常数不变,设转化的CO为x mol。
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)1 3 0 0
转化浓度(mol/L)x x x x
平衡浓度(mol/L)(1-x) (3-x) x x
则x2/(1-x)(3-x)=1,解得x=3/4,即达平衡时,CO转化了3/4 mol。转化为P4的Ca5(PO4)3F质量为a×10%×b%kg,根据反应4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4知生成CO的质量为(30×28×a×10%×b%)/(4×504)kg,则转化的CO的质量为3(30×28×a×10%×b%)/4(4×504)kg,根据反应:CO(g)+H2O(g)
2CaF2+30CO+18CaSiO3+3P4知生成CO的质量为(30×28×a×10%×b%)/(4×504)kg,则转化的CO的质量为3(30×28×a×10%×b%)/4(4×504)kg,根据反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)知相同条件下达平衡时能产生H2的质量为3(30×28×a×10%×b%)/56(4×504)kg=
CO2(g)+H2(g)知相同条件下达平衡时能产生H2的质量为3(30×28×a×10%×b%)/56(4×504)kg=![]() kg。
kg。

【题目】某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品, 经了解其来源并查阅相关资料(如下表),初步确认为铜制品。
紫铜 | 青铜 | 铜绿 | |
主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
性质与用途 | 紫红色, 质软,导电性能良好;主要用作电线电缆。 | 多呈灰绿色, 熔点低、硬度大、 可塑性强;可铸造成各种器具。 | 不溶于水的灰绿色粉末,溶于酸, 加热易分解;可作颜料、杀虫剂。 |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3 ];
除上述猜想外,其他合理的猜想是____________________(只写一个)。
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是________________________。
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是__________________。
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3 ]。于是按图5所示装置进行实验。
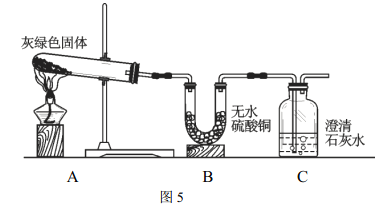
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了___________的现象, C中观察到了_____________的现象。B中所发生反应的化学方程式为:__________________。
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是______________。
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:___________________________。




