题目内容
【题目】氯碱厂电解饱和氯化钠溶液制取氢氧化钠的工艺流程:
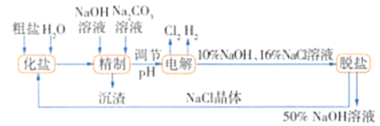
依据图中所给信息,完成下列填空:
(1)电解时发生反应的化学方程式为________________。
(2)粗盐含Ca2+、Mg2+等杂质,加入NaOH溶液、Na2CO3溶液的目的就是除去这些杂质,但如果精制时发现其中SO42-含量也较高,必须添加含钡离子的试剂除去SO42-,该试剂可以是________(填序号)。
a. Ba(OH)2溶液 b.Ba(NO3)2溶液 c.BaCl2溶液
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(填序号)。
a.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
b.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
c.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
【答案】![]() ac bc
ac bc
【解析】
(1)根据反应物和生成物写出反应方程式;
(2)除杂试剂要求不引入新的杂质;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在氯化钡之后。
(1)电解后产生氢气、氯气和氢氧化钠,则方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂选择的原则是不引入难以除去的杂质离子;
a.Ba(OH)2 ,加入过量试剂可以除去硫酸根离子,过量氢氧根离子在最后加盐酸除去,故a符合;
b.Ba(NO3)2,加入过量试剂,硝酸根离子不能除去,引入杂质离子硝酸根,故b不符合;
c.BaCl2,加入过量试剂硫酸根离子全部沉淀,氯离子不是杂质离子,故c符合;
故选ac;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项bc符合,故答案为:bc。

 期末1卷素质教育评估卷系列答案
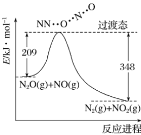
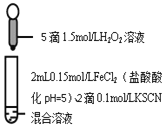
期末1卷素质教育评估卷系列答案【题目】某同学用KSCN溶液和![]() 溶液探究
溶液探究![]() 的还原性时出现异常现象,实验如下:
的还原性时出现异常现象,实验如下:
|
|
|
|
|
|
溶液变红,大约10秒左右红色褪去,有气体生成 | 溶液变红且不褪色,有气体生成 | 溶液变红且不褪色,滴加盐酸和 |
下列说法不正确的是
A.对比![]() ,可以判定酸性条件下
,可以判定酸性条件下![]() 可以氧化
可以氧化![]()
B.实验![]() 中发生的氧化还原反应有两种
中发生的氧化还原反应有两种
C.![]() 中红色溶液中含有
中红色溶液中含有![]() 胶体
胶体
D.![]() 中发生的氧化还原反应为:
中发生的氧化还原反应为:![]()
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
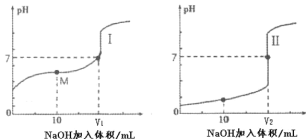
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑