题目内容
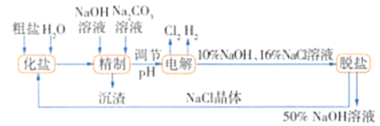
【题目】从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:

(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
【答案】![]() (或
(或![]() 、
、![]() )
) ![]() 、
、![]()
![]() 海边(或沿海陆地)
海边(或沿海陆地)
【解析】
(1)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水;
(4)从经济效益角度看,原料在海水和海滩上。
(1)用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为:![]() 或
或![]() 或
或![]() ,故答案为:
,故答案为:![]() (或
(或![]() 、
、![]() );
);
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙,反应方程式为:CaCO3![]() CaO+CO2↑、CaO+H2O=Ca(OH)2,故答案为:CaCO3
CaO+CO2↑、CaO+H2O=Ca(OH)2,故答案为:CaCO3![]() CaO+CO2↑、CaO+H2O=Ca(OH)2;
CaO+CO2↑、CaO+H2O=Ca(OH)2;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)从经济效益角度看,该化工厂厂址应选在沿海陆地,因为其原料在海水和海滩上,故答案为:海边(或沿海陆地)。

 互动英语系列答案
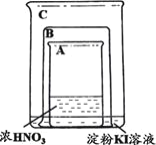
互动英语系列答案【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住。 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色。 |
下列说法不合理的是
A.烧杯A中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.红棕色气体消失可能与NO2和烧杯C中的KI发生反应有关
C.烧杯A中溶液变蓝是因为产生了Cu(NO3)2
D.若将铜片换成铁片,则C中的液体不会变蓝
【题目】下列实验中的操作,对应的现象以及结论都正确的是![]()
![]()
选项 | 操作 | 现象 | 结论 |
A | 向 | 产生白色沉淀 |
|
B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
C | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有 |
D | 炭粉中加入浓硫酸并加热,导出的气体通入 | 有白色沉淀产生 | 有 |
A.AB.BC.CD.D