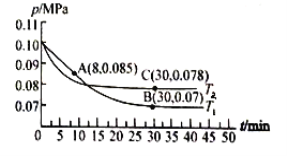
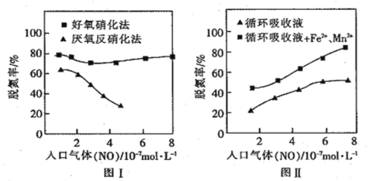
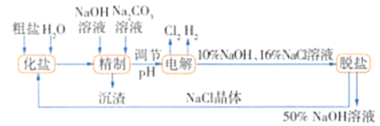
题目内容
【题目】将两份质量均为mg的铝片分别置于盛有盐酸、NaOH溶液的两个烧杯中,待反应结束后,测得两个烧杯中溶液的质量均增加了![]() ,下列有关说法中错误的是
,下列有关说法中错误的是
A.![]()
B.两个烧杯中发生的反应所转移的电子数均为0.3NA
C.两个烧杯中消耗的溶质的物质的量之比为![]()
D.两个烧杯中生成的氢气的体积均为![]()
【答案】D
【解析】
A.因两个烧杯中溶液的质量均增加了![]() ,可知消耗铝的量相等至少为
,可知消耗铝的量相等至少为![]() ,A正确,不符合题意;
,A正确,不符合题意;
B.因两个烧杯中溶液的质量均增加了![]() ,可知消耗铝的量相等至少为
,可知消耗铝的量相等至少为![]() ,并且生成氢气的量相等0.3g,由得失电子守恒知,转移的电子数相等0.3NA,B正确,不符合题意;
,并且生成氢气的量相等0.3g,由得失电子守恒知,转移的电子数相等0.3NA,B正确,不符合题意;
C.由反应后,生成等物质的量的![]() 、
、![]() ,根据原子守恒,知盐酸的物质的量为NaOH的3倍,C正确,不符合题意;
,根据原子守恒,知盐酸的物质的量为NaOH的3倍,C正确,不符合题意;
D.质量均增加了![]() ,可知消耗铝的量相等至少为
,可知消耗铝的量相等至少为![]() ,并且生成氢气的量相等0.3g,生成
,并且生成氢气的量相等0.3g,生成![]() ,标准状况下,体积为
,标准状况下,体积为![]() ,其他条件下,不能确定气体体积,D错误,符合题意;
,其他条件下,不能确定气体体积,D错误,符合题意;
故答案为D。

【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
① |
| 稀盐酸 | 偏向 |
② |
| 稀盐酸 | 偏向 |
③ |
| 稀盐酸 | 偏向石墨 |
④ |
| 氢氧化钠溶液 | 偏向 |
⑤ |
| 浓硝酸 | 偏向 |
试根据表中的电流表指针偏转方向回答下列问题:
(1)实验1、2中![]() 所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
(2)由实验3完成下列填空:
①铝为________极,电极反应式为________________;
②石墨为________极,电极反应式为________________;
③电池总反应为________。
(3)实验4中铝作负极还是正极?________,理由是_______。写出铝电极的电极反应式:_______。
(4)解释实验5中电流表指针偏向铝的原因:_________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________。
【题目】根据表中信息判断,下列选项不正确的是
序号 | 反应物及反应条件 | 产物 |
① |
|
|
② |
|
|
③ |
|
|
④ |
| Ag、 |
A.第①组反应固体X中不含Fe
B.第②组反应中![]() 全部被氧化为
全部被氧化为![]()
![]()
D.第④组反应中![]() 既是氧化剂又是还原剂
既是氧化剂又是还原剂