题目内容
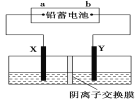
【题目】某研究性学习小组利用以下装置电解饱和食盐水,同时测定电解时产生的氢气的体积和检验氯气的氧化性。

(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母):A 接_____,_____接_____,B接_____,_______接_____________。
(2)实验时用石墨和铁为电极,则铁电极接电源的_____极,所发生的电极反应式为_____。
(3)实验测得产生的氢气体积(已折算成标准状况)为 5.60 mL,电解后溶液的体积恰好为 50.0 mL,则溶液中 OH-的浓度为_____。
【答案】G F H D E C 负 2H++2e-=H2↑ 0.01mol/L
【解析】
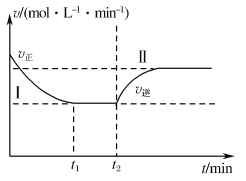
用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,即a电极为铁,应为电解池的阴极,则生成氢气,可知b端为氯气,A接储气瓶的g→f,把水排入量筒内,用量筒测量出排出的水量,以测定产生H2的体积,用淀粉KI溶液检验氯气,用NaOH溶液吸收氯气,防止污染环境,以此解答该题。
(1)由以上分析可知A接储气瓶的G→F,把水排入量筒内,用量筒测量出排出的水量,以测定产生H2的体积,B接洗气瓶的D→E,生成的Cl2在洗气瓶中使淀粉碘化钾溶液变蓝,多余的Cl2用NaOH溶液吸收,故答案为:G;F;H;D;E;C;
(2)装置中的铁电极连接电源的负极,为电解池阴极得电子发生还原反应,所发生的反应为2H++2e-═H2↑,故答案为:负;2Cl--2e-═Cl2↑;
(3)氢气物质的量为![]() =0.00025mol,由2NaCl+2H2O
=0.00025mol,由2NaCl+2H2O 2NaOH+Cl2↑+H2↑可知,n(NaOH)=2n(H2)=0.0005mol,则c(OH-)=
2NaOH+Cl2↑+H2↑可知,n(NaOH)=2n(H2)=0.0005mol,则c(OH-)=![]() =0.01molL-1,故答案为:0.01。
=0.01molL-1,故答案为:0.01。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目