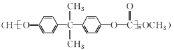
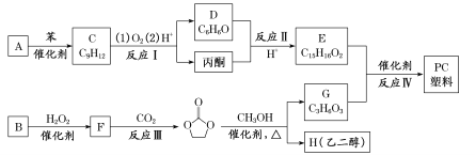
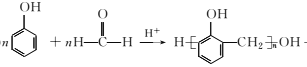题目内容
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl﹣、SO42﹣)中回收氧化铁流程如图:

已知:常温下Ksp[Mg(OH)2]=1.2×10﹣11; Ksp[Fe(OH)2]=2.2×10﹣16;Ksp[Fe(OH)3]=3.5×10﹣38;Ksp[Al(OH)3]=1.0×10﹣33。
(1)写出在该酸性废液中通入空气时发生的离子反应方程式_____。
(2)常温下,根据已知条件在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_____。
(3)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
【答案】4Fe2++O2+4H+=4Fe3++2H2O; 3.5×10-11mol·L-1 Al(OH)3 NaOH
【解析】
(1)酸性废液中含有Fe2+,Fe2+能被氧气氧化进行分析;
(2)根据溶度积进行计算;
(3)根据溶度积进行分析和计算。
(1)酸性废液中含有Fe2+,Fe2+能被O2氧化,因此离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
答案:4Fe2++O2+4H+=4Fe3++2H2O;
(2)溶液的pH=5,则溶液c(OH-)=![]() mol·L-1=10-9mol·L-1,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),代入数值,得到c(Fe3+)=
mol·L-1=10-9mol·L-1,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),代入数值,得到c(Fe3+)=![]() mol·L-1=3.5×10-11mol·L-1;
mol·L-1=3.5×10-11mol·L-1;
答案:3.5×10-11mol·L-1;
(3) 溶液的pH=5,则溶液c(OH-)=![]() mol·L-1=10-9mol·L-1,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)代入数值,c(Mg2+)=1.2×107mol·L-1,说明Mg2+没有出现沉淀,Ksp[Al(OH)3]=c(Al3+)×c3(OH-),代入数值,得出c(Al3+)=10-6mol·L-1<1×10-5mol·L-1,说明Al3+几乎完全沉淀,混有的杂质为Al(OH)3,Al(OH)3属于两性氢氧化物,Fe(OH)3为碱性氢氧化物,因此需要加入NaOH溶液溶解Al(OH)3;
mol·L-1=10-9mol·L-1,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)代入数值,c(Mg2+)=1.2×107mol·L-1,说明Mg2+没有出现沉淀,Ksp[Al(OH)3]=c(Al3+)×c3(OH-),代入数值,得出c(Al3+)=10-6mol·L-1<1×10-5mol·L-1,说明Al3+几乎完全沉淀,混有的杂质为Al(OH)3,Al(OH)3属于两性氢氧化物,Fe(OH)3为碱性氢氧化物,因此需要加入NaOH溶液溶解Al(OH)3;
答案:Al(OH)3;NaOH。