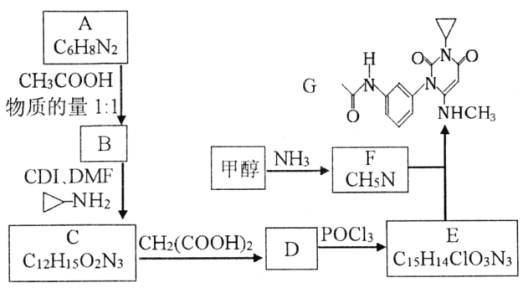
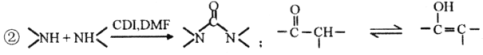题目内容
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如图:
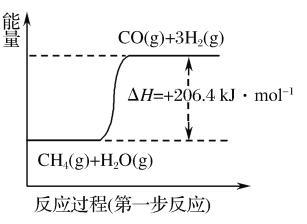

结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:___。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。
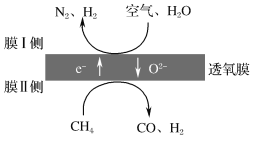
①起还原作用的物质是___。
②膜Ⅰ侧所得气体中![]() =2,CH4、H2O、O2反应的化学方程式是___。
=2,CH4、H2O、O2反应的化学方程式是___。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
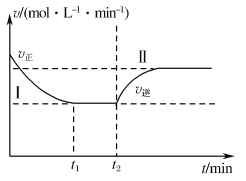
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:φ(Ⅰ)<φ(Ⅱ)
C.Ⅰ、Ⅱ两过程达到平衡的标志是混合气体的密度不再发生变化
D.t2min时改变的条件可以是向密闭容器中加N2和H2的混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器中充入9.0molN2和23.0molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图。
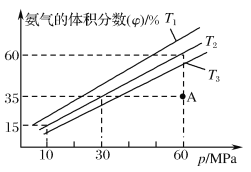
①T1、T2、T3由大到小的排序为___。
②在T2、60MPa条件下,A点v正___(填“>”“<”或“=”)v逆,理由是___。
③计算T2、60MPa平衡体系的平衡常数Kp=___MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字)。
【答案】CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1 CH4 10CH4+8H2O+O2=10CO+28H2 D T3>T2>T1 > T2、60MPa时A点未达到平衡时的体积分数,反应正向进行 0.043或0.0427(MPa)-2
【解析】
(1).结合图象可知,第一步反应的热化学方程式为①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1,第二步反应的热化学方程式为②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.0 kJ·mol-1,根据盖斯定律,由①+②得:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1,故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1;
(2).①结合工作原理图知,膜Ⅰ侧反应物为空气中的O2和H2O,得电子生成O2-和H2;膜Ⅱ侧反应物为CH4和O2-,失去电子生成CO和H2,起还原作用的是CH4,故答案为:CH4;
②设膜Ⅰ侧参加反应的空气中的n(N2)=4 mol、n(O2)=1 mol,则膜Ⅰ侧所得气体中n(N2)=4 mol、n(H2)=8 mol,膜Ⅰ侧的还原反应为O2+4e-=2O2-和H2O+2e-===H2↑+O2-,则n(O2)反应=1 mol,n(H2O)反应=8 mol,膜Ⅱ侧的氧化反应为CH4+O2--2e-=2H2+CO,根据得失电子守恒,膜Ⅱ侧n(CH4)反应=10 mol,故CH4、H2O、O2反应的化学方程式为10CH4+8H2O+O2=10CO+28H2;故答案为:10CH4+8H2O+O2=10CO+28H2;
(3).温度不变,平衡常数K不变,A项错误;若t2 min时改变的条件是大量通入N2或H2,则平衡时NH3的体积分数:φ(Ⅱ)<φ(Ⅰ),B项错误;容器恒容,且过程Ⅰ和Ⅱ中混合气体的质量不变,混合气体的密度为固定值,C项错误;t2 min时改变条件,v逆瞬时不变后逐渐增大至不变,则平衡正向移动,所以改变的条件是向容器中加入反应物(可以是N2或H2或N2和H2的混合气),D项正确,故选D;
(4).①合成氨反应的正反应为放热反应,温度越高平衡时NH3的体积分数越小,所以T3>T2>T1;故答案为:T3>T2>T1;
②在T2、60 MPa条件下,A点时NH3的体积分数小于平衡时NH3的体积分数,此时反应正向进行,所以v正>v逆,故答案为:>;T2、60MPa时A点未达到平衡时的体积分数,反应正向进行;
③结合图象知T2、60 MPa平衡时NH3的体积分数为60%,则平衡时φ(N2)=15%,φ(H2)=25%,Kp=(60MPa×60%)2/[(60 MPa×15%)×(60 MPa×25%)3]≈0.043(MPa)-2,故答案为:0.043或0.0427(MPa)-2。

【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
【题目】以低品位红土镍矿(主要成分可表示为![]() 、
、![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 、
、![]() )为原料制备纳米级
)为原料制备纳米级![]() 的工艺流程如下:
的工艺流程如下:

已知氢氧化物的参数如下表:
氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
|
| 4.1 | 5.5 |
|
| 2.2 | 3.5 |
|
| 6.7 | 9.5 |
|
| 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______(填化学式)。
(2)常温下,调![]() 的目的是______。当
的目的是______。当![]() 时,溶液中
时,溶液中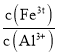 =______
=______
(3)写出“除铜镍”过程发生反应的离子方程式为![]() 、______________。“除钙”过程反应温度不宜超过
、______________。“除钙”过程反应温度不宜超过![]() 的原因_________________________。
的原因_________________________。
(4)“滤液”中溶质的主要成分为________________,获取该物质晶体的具体实验操作为__________。