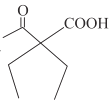
题目内容
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液(足量),装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是( )
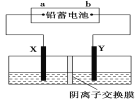
A.a为铅蓄电池的负极
B.电解过程中SO42-向右侧移动
C.电解结束时,左侧溶液质量增重8 g
D.铅蓄电池工作时正极电极反应式为:PbSO4+2e-===Pb+SO42-
【答案】C
【解析】
A.电解池的Y极有Cu析出,则Y为阴极,b为铅蓄电池的负极,故A错误;
B.电解过程中SO42-向电解池的阳极X极移动,即左侧移动,故B错误;
C.电解过程中,阴极析出6.4g铜的物质的量为0.1mol,转移电子为0.2mol,则同时有0.2mol÷2=0.1mol的SO42-进入左侧,其质量为0.1mol×96g/mol=9.6 g,且阳极上有0.2mol÷4=0.05 molO2生成,其质量为0.05mol×32g/mol=1.6 g,故结束时,左侧溶液质量增重9.6 g-1.6 g=8 g ,故C正确;
D.铅蓄电池工作时正极电极反应式为:4H++PbO2+2e-+SO42-=PbSO4 ↓+2H2O,故D错误;答案为C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、![]() 、FeO、
、FeO、![]() ,、
,、![]() 等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取
等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取![]() 的工艺流程如下:
的工艺流程如下:
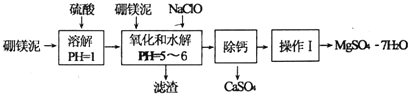
已知:NaClO与![]() 反应产生
反应产生![]() 沉淀.
沉淀.
沉淀物 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
![]() 实验中需用
实验中需用![]() 的硫酸
的硫酸![]() 若用
若用![]() 的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
![]() 滤渣的主要成分除含有
滤渣的主要成分除含有![]() 、
、![]() 外,还有 ______ .
外,还有 ______ .
![]() “操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
“操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
![]() 写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
![]() 已知:溶液的
已知:溶液的![]() 时,铝元素有多种存在形态,如
时,铝元素有多种存在形态,如![]() 、
、![]() 、
、![]() 等,各形态之间可相互转化,写出该溶液中
等,各形态之间可相互转化,写出该溶液中![]() 转化为
转化为![]() 的离子方程式 ______ ;
的离子方程式 ______ ;
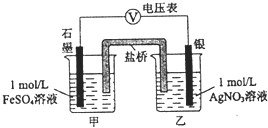
![]() 某同学为探究
某同学为探究![]() 和
和![]() 反应,按如图连接装置并加入药品
反应,按如图连接装置并加入药品![]() 盐桥中的物质不参与反应
盐桥中的物质不参与反应![]() ,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓
,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓![]() 溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极
溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() 由实验得出
由实验得出![]() 和
和![]() 反应的离子方程式是 ______
反应的离子方程式是 ______
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。