题目内容
4.某溶液中可能有下列阴离子中的一种或几种:SO42-、CO32-、Cl-、OH-.(1)当溶液中有大量H+存在时,则不可能有OH-、CO32-存在,发生反应的离子方程式2H++CO32-=H2O+CO2↑(或H++CO32-=HCO3-)、OH-+H+=H2O;
(2)当溶液中有大量Ba2+存在时,则不可能有SO42-、CO32- 存在,发生反应的离子方程式SO42-+Ba2+=BaSO4↓、CO32-+Ba2+=BaCO3↓;
(3)检验某溶液中是否存在SO42-的试剂为稀盐酸和BaCl2.
分析 (1)氢离子与碳酸根离子反应生成二氧化碳气体,氢离子与氢氧根离子反应生成水;
(2)钡离子与硫酸根离子、碳酸根离子反应生成难溶物碳酸钡、硫酸钡;
(3)先用稀盐酸除去干扰离子,然后用氯化钡溶液具有硫酸根离子.
解答 解:(1)当溶液中有大量H+存在时,OH-、CO32-能够与氢离子发生反应,在溶液中不能大量共存,反应的离子方程式为:2H++CO32-=H2O+CO2↑(或H++CO32-=HCO3-)、OH-+H+=H2O,
故答案为:OH-、CO32-;2H++CO32-=H2O+CO2↑(或H++CO32-=HCO3-)、OH-+H+=H2O;
(2)当溶液中有大量Ba2+存在时,SO42-、CO32-能够与Ba2+发生反应生成难溶物,在溶液中不能大量共存,发生反应为:SO42-+Ba2+=BaSO4↓、CO32-+Ba2+=BaCO3↓,
故答案为:SO42-、CO32-;SO42-+Ba2+=BaSO4↓、CO32-+Ba2+=BaCO3↓;
(3)检验 SO42-时要避免SO32-的影响,就不要加入稀硝酸,因为稀硝酸能把SO32- 氧化为SO42-,从而干扰SO42- 的检验;要先加入过量稀盐酸,以除去 SO32-、CO32- 等离子的影响,同时,当加入稀盐酸时没有沉淀,可排除Cl-的影响.当然,若溶液中不含SO32-离子,则加入稀硝酸也可.检验SO42-可用BaCl2溶液,看有没有白色沉淀产生;综上分析可知,检验某溶液中是否含有SO42-的操作方法是:首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,即:选用试剂为:稀盐酸和BaCl2,
故答案为:稀盐酸和BaCl2.
点评 本题考查了离子共存、离子方程式的书写,题目难度中等,注意掌握离子反应发生条件,明确离子方程式的书写原则及离子共存的判断方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH${\;}_{4}^{+}$的物质的量相同 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| 容器编号 | 温度/℃ | 容器体积/L | 平衡时O2转化率 | 平衡时压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1<p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
| A. | 10mL0.1 mol•L-1的AlCl3溶液 | B. | 20mL0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30mL0.2 mol•L-1的KCl溶液 | D. | 100mL0.25 mol•L-1的NaCl溶液 |
 下表各组物质中,通过一步反应不能实现如图所示转化的是( )
下表各组物质中,通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | NO | NO2 | HNO3 |
| D | Fe2O3 | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c( R2-)+c( HR- )=c( Na+ ) | |
| B. | 某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:c( Cl- )>c( NH4+ )>c( H+ )=c( OH- ) | |
| C. | 某物质的溶液中由水电离出的c ( H+ )=1×10-amol•L-1,若a>7,则溶液的pH一定为14-a | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2 c( OH- )+c( A- )=2 c( H+ )+c( HA ) |
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目
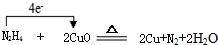 .
. 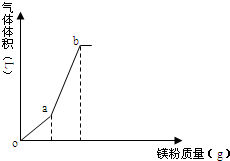 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )| A. | o点时,溶液显酸性的主要原因为:NH4++H2O═NH3•H2O+H+ | |
| B. | oa段溶液pH增大,c(NH4+)减小 | |
| C. | b点溶液显中性 | |
| D. | a、b点气体体积比为1:3 |