题目内容
6.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH${\;}_{4}^{+}$的物质的量相同 |
分析 A.电解精炼过程粗铜做阳极,杂质铁、锌、镍等通电时也失电子,依据电解过程中电子守恒分析;
B.过氧化钠中含有钠离子和过氧根离子,1mol过氧化钠中含有2mol钠离子和1mol过氧根离子;
C.羟基中含有9个电子,氨气分子中含有10个电子;
D.铵根离子的浓度不同,其水解程度不同,则溶液中铵根离子的物质的量不同.
解答 解:A.电解精炼铜的过程中转移了NA个电子,阳极溶解失电子的有铜、铁、锌、镍等,依据电子守恒阳极溶解铜的质量小于32g,故A错误;
B.1mol过氧化钠中含有2mol钠离子和1mol过氧根离子,总共含有3mol离子,含离子总数为3NA,故B错误;
C.1mol羟基(-OH)中含有9mol电子,17gNH3所含电子为10mol,二者所含电子数之比为9:10,故C正确;
D.一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液,两溶液中溶质的物质的量都是0.5mol,但是铵根离子浓度越大,其水解程度越小,所以两溶液中铵根离子的水解程度不同,则铵根离子的物质的量不同,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算和判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度等物理量之间的关系,明确盐的水解原理及其影响.

练习册系列答案
相关题目
16.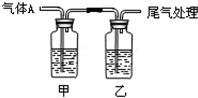 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )
 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )| 选项 | 足量 气体A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
| A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
| B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
| C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
| D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3•H2O电离出OH- |
| A. | A | B. | B | C. | C | D. | D |
1.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
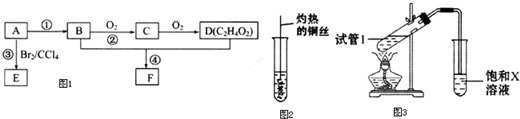
 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.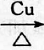 2CH3CHO+2H2O.
2CH3CHO+2H2O.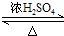 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.