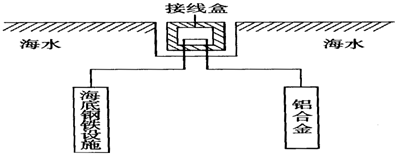
题目内容
15.分子式为C5H10O2的羧酸和酯且有3个甲基的同分异构体共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 C5H10O2的羧酸含有羧基-COOH,剩余部分为丁基,酯中含有官能团为-COO-,还必须满足含有3个甲基,据此解答即可.
解答 解:C5H10O2的羧酸含有羧基-COOH,剩余部分为丁基,含有3个甲基的丁基为:2,2-二甲基丙酸,故总共有1种;
酯中含有官能团为-COO-,若含有3个甲基,可以是HCOOC(CH3)3、CH3COOCH(CH3)2、和(CH3)2CHCOOCH3,总共有3种,故选B.
点评 本题主要考查的是同分异构体的判断与书写,掌握所给的信息是解决本题的关键,难度较大.

练习册系列答案
相关题目
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
10.某芳香化合物的分子式为C8H8Cl2O2,其分子结构中有三种不同化学环境的氢原子,它们的数目之比为6:1:1,且分子中的Cl原子皆形成C-Cl键,则其同分异构体数目与下列那种有机物的相同(不考虑O与O相连)( )
| A. | C4H8 | B. | C2H6O | C. | C3H6O | D. | C2H4O2 |
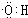 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.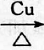 2CH3CHO+2H2O.
2CH3CHO+2H2O.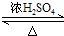 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.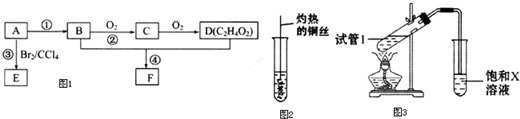

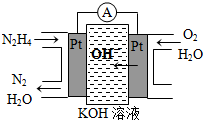 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题