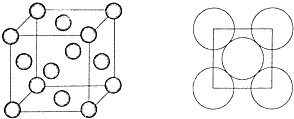
题目内容
13.在2014年国家科学技术奖励大会上,甲醇制取低碳烯烃技术(DMTO)获国家技术发明奖一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).

①为尽可能多地获得乙烯,控制的生产条件为530℃、0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)在压强为P1 时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图.
分析 (1)煤的气化是指煤与水蒸气反应生成CO与H2的过程.
(2)①因温度高不利于平衡向放热反应方向移动,从而导致平衡常数减小,而反应①在700℃时的平衡常数比在500℃时的平衡常数小,故①的正反应是放热反应,依据盖斯定律,用热化学方程式①+②就可得热化学方程式③式得到abc的关系;
②反应①②的平衡常数表达式相乘得到反应③的平衡常数,K3=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{{c}^{2}({H}_{2})×c(C{O}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$=$\frac{c(CO)×c({H}_{2}O)}{c({H}_{2})×c(C{O}_{2})}$,依据数据计算浓度商Qc和得到的平衡常数比较判断反应进行的方向,比较甲醇的生成速率和消耗速率大小.
(3)①由图1知,530℃,0.1Mpa时乙烯的选择性最大;
②t0时刻,n(H2O)=3.6mol n(CH2=CH2)=1.8mol,设甲醇起始物质的量为x mol,
2CH3OH(g)?CH2=CH2(g)+2H2O(g)
起始量(mol) x 0 0
变化量(mol) 3.6 1.8 3.6
t0时刻量(mol) x-3.6 1.8 3.6
$\frac{x-3.6}{x-3.6+1.8+3.6}=10%$,
得到x计算甲醇的转化率;
因压强变大后平衡向右移动,导致生成水的量增大,绘制图象时应注意条件改变后水的物质的量没有立即变化,重新达到平衡所需要的时间应比t3多.
解答 解:(1)煤的气化是指煤与水蒸气反应生成CO与H2的过程,反应的化学方程式为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
故答案为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)①因温度高不利于平衡向放热反应方向移动,从而导致平衡常数减小,而反应①在700℃时的平衡常数比在500℃时的平衡常数小,故①的正反应是放热反应,a<0;
依据盖斯定律计算①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1
用①+②就可得③的热化学方程式:3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=(a+b)KJ/mol=c kJ•mol-1,得到c=a+b;
故答案为:<;c=a+b;
②反应①②的平衡常数相乘得到反应③的平衡常数K3=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{{c}^{3}({H}_{2})c(C{O}_{2})}$×$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$=$\frac{c(CO)×c({H}_{2}O)}{c({H}_{2})×c(C{O}_{2})}$=2.5×1=2.5,
若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10,mol、10mol,易求得Qc=$\frac{\frac{10}{2}×\frac{10}{2}}{(\frac{6}{2})^{3}×\frac{2}{2}}$=$\frac{25}{27}$<2.5,故此时反应向右进行,甲醇的生成速率大于其消耗速率;
故答案为:2.5;>;
(3)①由图1知,530℃,0.1Mpa时乙烯的选择性最大,为尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa;
故答案为:530℃,0.1Mpa;
②t0时刻,n(H2O)=3.6mol n(CH2=CH2)=1.8mol,设甲醇起始物质的量为x mol,
2CH3OH(g)?CH2=CH2(g)+2H2O(g)
起始量(mol) x 0 0
变化量(mol) 3.6 1.8 3.6
t0时刻量(mol) x-3.6 1.8 3.6
$\frac{x-3.6}{x-3.6+1.8+3.6}=10%$,
x=4.2mol
则甲醇的转化率为$\frac{3.6}{4.2}$×100%=85.7%
若在t1 时刻将容器容积快速扩大到原来的2倍,因压强变大后平衡向右移动,导致生成水的量增大,绘制图象时应注意条件改变后水的物质的量没有立即变化,重新达到平衡所需要的时间应比t3多,在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图为: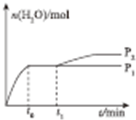 ;
;
故答案为:85.7%; .
.
点评 本题考查了化学平衡的影响因素分析,平衡计算应用,图象的方法判断,热化学方程式的计算书写,注意平衡常数的计算应用,掌握基础是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 化学反应的实质是旧键的断裂和新化学键生成 | |
| B. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| C. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 | |
| D. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
| A. | 澄清的石灰水,浓H2SO4 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 浓H2SO4,酸性KMnO4溶液 |
| A. | 原子序数:d>c>b>a | B. | 原子半径:r (A)>r (B)>r (D)>r (C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r (C3-)>r (D-)>r (B+)>r (A2+) |
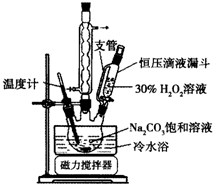 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.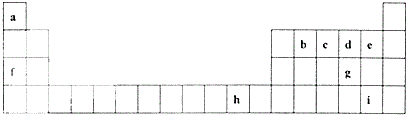 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素. .
.