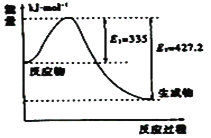
题目内容
【题目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________,若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
【答案】> [c(C)]2/[c(A)]2c(B) 减小 bc c 75%
【解析】
(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,据此判断a、b大小关系;
(2)化学平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;根据反应的热效应判断化学平衡常数的变化;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)根据化学反应速率影响因素和化学平衡移动影响因素判断;
(5)根据三段式以及平衡常数求出转化的CO2浓度,根据转化率=![]() 求解。
求解。
(1)热化学方程式表达的意义为:当2molA2和1molB2完全反应时,放出热量为akJ,而加入2molA2和1molB2达到平衡时,反应没有完全进行,即释放的热量小于完全反应释放的热量,即a>b;
(2)化学平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,故平衡常数表达式K=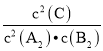 ;正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小;
;正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小;
(3)a.v(C)=2v(B2),从反应开始平衡一直有这样的等量关系,所以不能作平衡状态的标志,故a错误;
b.容器内压强保持不变,说明总物质的量不变,正逆反应速率相等,故b正确;
c.v逆(A2)=2v逆(B2)=2v正(B2),说明达平衡状态,故c正确;
d.容器内的密度保持不变,从反应开始平衡一直有这样的等量关系,所以不能作平衡状态的标志,故d错误;
(4)a.生成物浓度降低,则化学反应速率降低,故a错误;
b.升高温度,化学反应速率增大,但化学平衡向逆反应方向移动,故b错误;
c.反应物浓度增大,化学反应速率增大,化学平衡向正反应方向移动,故c正确;
d.催化剂只影响反应速率,不影响化学平衡,故d错误;
(5) CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始(mol/L) 0.02 0.02 0 0
转化量(mol/L) x x x x
平衡时(mol/L)0.02-x 0.02-x x x
根据平衡常数K=![]() =
=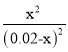 =9,解得x=0.015,故CO的转化率=
=9,解得x=0.015,故CO的转化率=![]() =75%。
=75%。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D