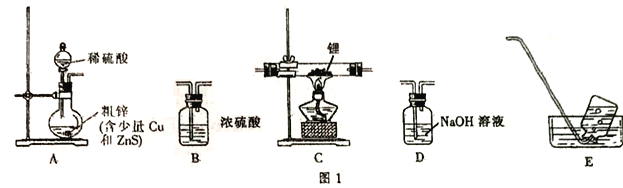
��Ŀ����
����Ŀ��ˮ��Һ�д��ڶ���ƽ�⣬�������ѧ��ѧ֪ʶ�ش��������⣺
��1����Ũ�Ⱦ�Ϊ0.1mol/L��CH3COONH4 ��NH4HSO4 ��NH3.H2O ��(NH4)2SO4��Һ�У�NH4+Ũ���ɴ�С��˳��Ϊ������ţ�___��
��2��Ũ�Ⱦ�Ϊ0.1mol��L��1��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ��������Һ�е�H��Ũ���ɴ�С��˳����(�����)___��
��3�������£���pH=6������ˮ�м���2.3g�����ƣ���ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH=___��
��4����FeCl3��NaHCO3��K2SO3��Һ���ɡ����պ�õ��Ĺ������ʷֱ���___��
���𰸡���>��>��>�� ��>��>��>�� 11 Fe2O3��Na2CO3��K2SO4
��������
��1����NH3H2O��Һ��NH3H2O���ֵ��룬c��NH4+����С����������ϵ����ˮ��̶ȿ����жϣ�
��2������Һ�м��������������H2O�ĵ��룬����Һ��H+��OH-Ũ��Խ����ˮ�������H+Ũ��ԽС���ε�ˮ���ܴٽ�ˮ�ĵ��룻
��3�������£�pH=6������ˮ��Kw=c��H+����c��OH-��=��10-6��2=10-12�������Һ����������Ũ�ȼ��ɣ�
��4����FeCl3��Һ����ʱ��������ˮ������Fe��OH��3��HCl�������¶�����������ֽ���Ǻ���ɫ����Fe2O3��̼�����Ʋ��ȶ����������ֽ�����̼���ƺ�ˮ��K2SO3���н�ǿ��ԭ�ԣ������ɵ�ʱ�����ױ������е���������������K2SO4��
��1����NH3H2O��Һ��c��NH4+��С����ε�c��NH4+��������һˮ�ϰ���Һ��笠�����Ũ����С������笠�����ϵ����2���٢���笠�����ϵ������1�����ԢܱȢ٢ڵĴ�������������笠�����ˮ�⣬����笠������ѶȢڣ��٣�����NH4+Ũ���ɴ�С��˳��Ϊ���ܣ��ڣ��٣��ۣ��ʴ�Ϊ���ܣ��ڣ��٣��ۣ�
��2������Һ�м��������������H2O�ĵ��룬����Һ��H+��OH-Ũ��Խ����ˮ�������H+Ũ��ԽС���ε�ˮ���ܴٽ�ˮ�ĵ��룬������ˮ�����c��H+���ɴ�С��˳��Ϊ���ܢڢۢ٣��ʴ�Ϊ���ܣ��ڣ��ۣ��٣�
��3�������£�pH=6������ˮ��Kw=c��H+����c��OH-��=��10-6��2=10-12��2.3g�����Ƶ����ʵ���n= ![]() =
= ![]() =0.1mol��c��OH-��=c��NaOH��=
=0.1mol��c��OH-��=c��NaOH��= ![]() =0.1mol/L��c��H+��=
=0.1mol/L��c��H+��= ![]() =10-11mol/L��������Һ��pH=11���ʴ�Ϊ��11��
=10-11mol/L��������Һ��pH=11���ʴ�Ϊ��11��
��4����FeCl3��Һ����ʱ��������ˮ������Fe��OH��3��HCl�������¶ȴٽ�HCl�ӷ�������������Һʱ�õ��������������ʱ������������ֽ���Ǻ���ɫ����Fe2O3����Ϊ̼�����Ʋ��ȶ����������ֽ�����̼���ƺ�ˮ����ѧ����ʽΪ��2NaHCO3 ![]() Na2CO3+CO2��+H2O������NaHCO3ˮ��Һ���ɲ����գ��õ���������Na2CO3��K2SO3���н�ǿ��ԭ�ԣ������ɵ�ʱ�����ױ������е���������������K2SO4�����õ��IJ���Ӧ����K2SO4��
Na2CO3+CO2��+H2O������NaHCO3ˮ��Һ���ɲ����գ��õ���������Na2CO3��K2SO3���н�ǿ��ԭ�ԣ������ɵ�ʱ�����ױ������е���������������K2SO4�����õ��IJ���Ӧ����K2SO4��

 �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵��ǣ� ��

ѡ�� | �� | �� | �� | ʵ����� |
A | ϡ���� | CaCO3 | Na2SiO3��Һ | �ǽ�����:Cl>C>Si |
B | Ũ���� | ���� | Ba(NO3)2��Һ | ��֤SO2������Ա��ο����ɰ�ɫ���� |
C | Ũ��ˮ | ��ʯ�� | ��̪��Һ | ������ˮ��Һ�ʼ��� |
D | Ũ���� | Fe | NaOH��Һ | ����Ũ���ᷴӦ������NO2 |
A. A B. B C. C D. D
����Ŀ���о���ѧ��Ӧʱ����Ҫ�������ʱ仯�������仯��ҲҪ��ע��Ӧ�Ŀ������ȡ��ش��������⣺
I.���з�Ӧ����![]() ����
����![]() ��
��
(1)����Ӧ���������ȷ�Ӧ����______![]() �����
�����![]() ��
��
(2)![]() ԭ��ص�װ����ͼ��ʾ��
ԭ��ص�װ����ͼ��ʾ��

����Һ��![]() ��______
��______![]() ������������ͭ��
������������ͭ��![]() �缫�����ƶ���
�缫�����ƶ���
��������������______�������ĵ缫��ӦʽΪ______��
![]() ij���淴Ӧ��
ij���淴Ӧ��![]() ��3�ֲ�ͬ�����½��У�B��D����ʼŨ�Ⱦ�Ϊ0����Ӧ��A��Ũ���淴Ӧʱ��ı仯������±���
��3�ֲ�ͬ�����½��У�B��D����ʼŨ�Ⱦ�Ϊ0����Ӧ��A��Ũ���淴Ӧʱ��ı仯������±���
ʵ����� | ʱ�� Ũ�� �¶� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 |
|
|
|
|
|
| |
2 | 800 |
|
|
|
|
|
|
|
3 | 950 |
|
|
|
|
|
|
|
(3)ʵ��1�У���![]() min�ڣ�������A��ʾ��ƽ����Ӧ����Ϊ______
min�ڣ�������A��ʾ��ƽ����Ӧ����Ϊ______![]() ��50minʱ��
��50minʱ��![]() ��
��![]() ______
______![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ��
��![]() ��
��
(4)0��20min�ڣ�ʵ��2��ʵ��1�ķ�Ӧ����______![]() ����������������
����������������![]() ����ԭ�������______��
����ԭ�������______��
(5)ʵ��3��ʵ��1�ķ�Ӧ���ʿ죬��ԭ����______��