题目内容
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
【答案】C
【解析】
A.存在平衡:2CrO42-(aq,黄色)+2H+(aq)![]() Cr2O72-(aq,橙色)+H2O(l),如颜色不变,说明浓度不变,则达到平衡状态,A正确;
Cr2O72-(aq,橙色)+H2O(l),如颜色不变,说明浓度不变,则达到平衡状态,A正确;
B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,设需要x mol FeSO4·7H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),解得x=1.65,m(FeSO47H2O)=1.65mol×278g/mol=458.7g,B正确;
C.转化后所得溶液中铬元素含量为28.6g/L,则1L废水中n(Cr)=28.6g÷52g/mol=0.55mol,CrO42-有10/11转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-10/11)=0.05mol/L,c(Cr2O72-)=0.55mol/L×10/11×1/2=0.25mol/L,由题中信息可知,常温下转换反应的平衡常数K=1×1014,则c(Cr2O72-)/c2(CrO42-)c2(H+)=1×1014,解得c(H+)=1×10-6mol/L,所以pH=6,C错误;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,则c(Cr3+)×c3(OH-)=1×10-32,解得c(OH-)=1×10-9mol/L,pH=5,D正确。
答案选C。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
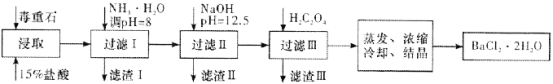
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
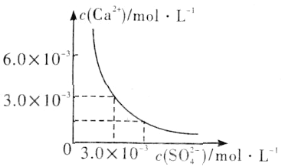
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
【题目】10 mL一定物质的量浓度的盐酸被一定物质的量浓度的NaOH溶液滴定的图示如下图,据图推出NaOH溶液和盐酸的物质的量浓度正确的是

A | B | C | D | |
c(HCl) | 0.12 | 0.04 | 0.12 | 0.09 |
c(NaOH) | 0.04 | 0.12 | 0.06 | 0.03 |
A. AB. BC. CD. D
