题目内容
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式___。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=___。
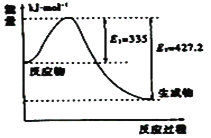
(3)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为:___;
②若起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=___kJ·mol-1。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1 432kJ/mol 46.1kJ 18.44 6(c-b)-2a
O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1 432kJ/mol 46.1kJ 18.44 6(c-b)-2a
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)反应热=反应物总键能-生成物总键能,据此计算;
(3)①先求出此反应的焓变,根据计算出每生成1molNH3放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1;
(4)根据盖斯定律求解。
:(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热352KJ×(32/16)=704KJ, 故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1;
O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1;
(2)反应热=反应物总键能-生成物总键能,所以436kJ/mol+243kJ/mol-2E(H-Cl)=-185kJ/mol,解得E(H-Cl)=432KJ/mol,故答案为:432kJ/mol;
(3)①该反应的焓变△H=E1-E2=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以每生成1molNH3放出热量为46.1kJ。故答案为:46.1kJ;
②反应方程式为![]() ,由①知生成1molNH3放出热量为46.1kJ。起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,反应的N2物质的量为1mol×20%=0.2mol,根据方程式可知生成的氨气为0.4mol,故放出的热量为46.1kJ×(0.4mol/1mol)= 18.44KJ,故答案为:18.44;
,由①知生成1molNH3放出热量为46.1kJ。起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,反应的N2物质的量为1mol×20%=0.2mol,根据方程式可知生成的氨气为0.4mol,故放出的热量为46.1kJ×(0.4mol/1mol)= 18.44KJ,故答案为:18.44;
(4)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJmol-1
②CO(g)+1/2O2(g)=CO2(g)△H=bkJmol-1
③C(石墨)+O2(g)=CO2(g)△H=ckJmol-1
依据盖斯定律(③-②)×6-①×2得到4Fe(s)+3O2(g)=2Fe2O3(s)△H=6(c-b)-2a kJmol-1,故答案为:6(c-b)-2a;