题目内容
【题目】CO2的富集与转化是当今环境研究的热点。
(1)化石燃料的燃烧是使大气CO2浓度增加的原因之一。汽油中含有辛烷(C8H18),1molC8H18(l)完全燃烧生成CO2(g)和H2O(l),放出5518kJ热量。写出C8H18完全燃烧的热化学方程式:__。
(2)一种富集CO2的过程如图所示。
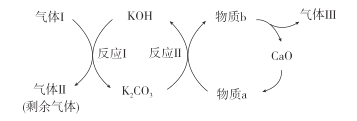
①气体Ⅰ、Ⅱ、Ⅲ中,CO2浓度最高的是___。
②反应Ⅱ的化学方程式是__。
(3)一定条件下,CO2和H2反应能生成C2H4,实现CO2向能源物质的转化。
已知:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH<0
①上述反应的ΔH可根据C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)和__反应的焓变计算。
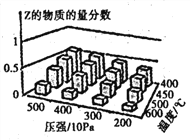
②研究温度和压强对CO2的平衡转化率的影响,结果如图所示。
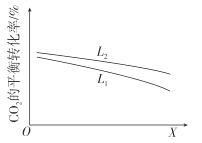
X代表的物理量是__。比较L1与L2的大小,并说明依据__。
③相同条件下,CO2和H2还能发生其它反应:
反应a:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
反应b:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
……
Fe和Co(钴)可作为该反应的催化剂。改变铁钴的物质的量比,测定相同时间内CO2的消耗率和含碳产物的占比,结果如下:
n(Fe):n(Co) | CO2消耗率/% | 含碳产物占比/% | ||
CO | C2H4 | CH4 | ||
100:0 | 1.1 | 100 | 0 | 0 |
50:50 | 30.5 | 36.8 | 20.3 | 42.9 |
0:100 | 69.2 | 2.7 | 0.2 | 97.1 |
结合数据,推测催化剂中钴的作用:__。
【答案】C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol Ⅲ K2CO3+Ca(OH)2=CaCO3↓+2KOH 2H2(g)+O2(g)=2H2O(g) 温度 反应2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)是气体体积缩小的反应,当温度一定时,增大压强,平衡正向移动,CO2的平衡转化率增大 钴能使反应物分子更易转化为活化分子,加快CO2被H2还原的反应速率;同时使CO2被H2还原得更充分,易生成含氢量高的CH4,提高烃的选择性
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol Ⅲ K2CO3+Ca(OH)2=CaCO3↓+2KOH 2H2(g)+O2(g)=2H2O(g) 温度 反应2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)是气体体积缩小的反应,当温度一定时,增大压强,平衡正向移动,CO2的平衡转化率增大 钴能使反应物分子更易转化为活化分子,加快CO2被H2还原的反应速率;同时使CO2被H2还原得更充分,易生成含氢量高的CH4,提高烃的选择性
【解析】
根据热化学方程式书写要求,完成书写,注意燃烧热的热化学方程式系数;根据图示信息分析过程反应,确定气体的组成及涉及的反应书写;根据盖斯定律分析;结合反应特点分析压强和温度对平衡的影响;根据表格数据分析Co的比例对反应物消耗率和产物比例的影响确定。
(1)1molC8H18(l)完全燃烧生成CO2(g)和H2O(l),放出5518kJ热量,该反应的热化学方程式为:C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol,故答案为:C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol,故答案为:C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol;
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol;
(2)由过程图示可知气体I与氢氧化钾反应,其中含有的二氧化碳被氢氧化钾吸收转变成碳酸钾,气体II中为其他气体,碳酸钾与物质a氢氧化钙反应,产生碳酸钙沉淀b,碳酸钙高温分解得到气体III(较纯净的二氧化碳),因此气体III中,二氧化碳的浓度最大,故答案为:III;
②由以上分析,反应II为碳酸钾与氢氧化钙的反应,反应方程式为:K2CO3+Ca(OH)2=CaCO3↓+2KOH,故答案为:K2CO3+Ca(OH)2=CaCO3↓+2KOH;
(3)①由盖斯定律可知,该反应2CO2(g)+6H2(g)C2H4(g)+4H2O(g),可由C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)与2H2(g)+O2(g)=2H2O(g)得到,故答案为:2H2(g)+O2(g)=2H2O(g);
②若X为压强,由图像可知随X的增大,二氧化碳转化率减小,说明反应逆向移动,而该反应正向气体分子数减小,增大压强平衡正向移动,因此X不是压强,应为温度,故答案为:温度;反应2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)是气体体积缩小的反应,当温度一定时,增大压强,平衡正向移动,CO2的平衡转化率增大;
③由表格信息可知,Co的占比越高,二氧化碳的消耗率越大,可知Co有利用二氧化碳转变成有机产物,同时Co的占比越高产物中甲烷的含量越高,可知Co对反应有一定的选择性,Co在反应中的作用为:钴能使反应物分子更易转化为活化分子,加快CO2被H2还原的反应速率;同时使CO2被H2还原得更充分,易生成含氢量高的CH4,提高烃的选择性,故答案为:钴能使反应物分子更易转化为活化分子,加快CO2被H2还原的反应速率;同时使CO2被H2还原得更充分,易生成含氢量高的CH4,提高烃的选择性;