题目内容
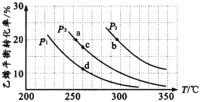
【题目】为探究外界条件对反应:mA(g) +nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
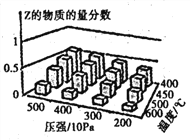
A.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H<0 m + n >c
D.△H>0 m +n<c
【答案】C
【解析】
A.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,相当于增大压强,平衡逆向移动,但Z的含量增大,A错误;
B.由图中信息可知,在相同压强下,温度越高则Z的物质的量分数越小,说明正反应是放热反应,升高温度正逆反应速率都加快,但平衡向逆反应方向移动,平衡常数减小,B错误;
C.正反应是放热的,则△H<0;由图中信息可知,在相同的温度下,压强越大Z的物质的量分数越大,说明减小压强化学平衡是向着气体分子数增加的方向进行的,所以有m+n>c,C正确;
D.根据C中分析可知D错误。
答案选C。

【题目】CO2的富集与转化是当今环境研究的热点。
(1)化石燃料的燃烧是使大气CO2浓度增加的原因之一。汽油中含有辛烷(C8H18),1molC8H18(l)完全燃烧生成CO2(g)和H2O(l),放出5518kJ热量。写出C8H18完全燃烧的热化学方程式:__。
(2)一种富集CO2的过程如图所示。
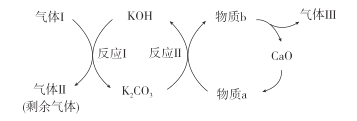
①气体Ⅰ、Ⅱ、Ⅲ中,CO2浓度最高的是___。
②反应Ⅱ的化学方程式是__。
(3)一定条件下,CO2和H2反应能生成C2H4,实现CO2向能源物质的转化。
已知:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH<0
①上述反应的ΔH可根据C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)和__反应的焓变计算。
②研究温度和压强对CO2的平衡转化率的影响,结果如图所示。
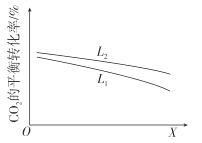
X代表的物理量是__。比较L1与L2的大小,并说明依据__。
③相同条件下,CO2和H2还能发生其它反应:
反应a:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
反应b:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
……
Fe和Co(钴)可作为该反应的催化剂。改变铁钴的物质的量比,测定相同时间内CO2的消耗率和含碳产物的占比,结果如下:
n(Fe):n(Co) | CO2消耗率/% | 含碳产物占比/% | ||
CO | C2H4 | CH4 | ||
100:0 | 1.1 | 100 | 0 | 0 |
50:50 | 30.5 | 36.8 | 20.3 | 42.9 |
0:100 | 69.2 | 2.7 | 0.2 | 97.1 |
结合数据,推测催化剂中钴的作用:__。