题目内容
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中存在平衡:Cl2+H2O![]() H++Clˉ+HClO,加入适量NaHCO3(s)后,溶液颜色变浅
H++Clˉ+HClO,加入适量NaHCO3(s)后,溶液颜色变浅
B.打开汽水瓶时有大量的气泡溢出
C.对于反应体系CO(g)+NO2(g)![]() NO(g)+CO2(g),给平衡体系增大压强可使颜色变深
NO(g)+CO2(g),给平衡体系增大压强可使颜色变深
D.对于反应2NO2(g)![]() N2O4(g)△H<0,平衡体系升高温度颜色变深
N2O4(g)△H<0,平衡体系升高温度颜色变深
【答案】C
【解析】
A.氯水中存在平衡:Cl2+H2O![]() H++Clˉ+HClO,加入NaHCO3(s)溶液,碳酸氢根会反应氢离子,使平衡正向移动,所以氯气的浓度减小,颜色变浅,可以用勒夏特列原理解释,故A不符合题意;
H++Clˉ+HClO,加入NaHCO3(s)溶液,碳酸氢根会反应氢离子,使平衡正向移动,所以氯气的浓度减小,颜色变浅,可以用勒夏特列原理解释,故A不符合题意;
B.溶液中存在二氧化碳的溶解平衡,开启汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故B不符合题意;
C.该反应前后气体系数之和相等,所以增大压强,平衡并不移动,不能用勒夏特列原理解释,故C符合题意;
D.该反应正反应为放热反应,升高温度平衡逆向移动,二氧化氮浓度变大颜色变深,能用勒夏特列原理解释,故D不符合题意;
综上所述答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】CO2的富集与转化是当今环境研究的热点。
(1)化石燃料的燃烧是使大气CO2浓度增加的原因之一。汽油中含有辛烷(C8H18),1molC8H18(l)完全燃烧生成CO2(g)和H2O(l),放出5518kJ热量。写出C8H18完全燃烧的热化学方程式:__。
(2)一种富集CO2的过程如图所示。
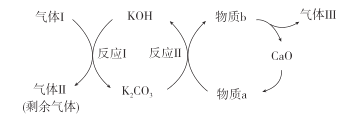
①气体Ⅰ、Ⅱ、Ⅲ中,CO2浓度最高的是___。
②反应Ⅱ的化学方程式是__。
(3)一定条件下,CO2和H2反应能生成C2H4,实现CO2向能源物质的转化。
已知:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH<0
①上述反应的ΔH可根据C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)和__反应的焓变计算。
②研究温度和压强对CO2的平衡转化率的影响,结果如图所示。
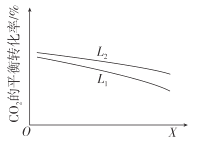
X代表的物理量是__。比较L1与L2的大小,并说明依据__。
③相同条件下,CO2和H2还能发生其它反应:
反应a:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
反应b:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
……
Fe和Co(钴)可作为该反应的催化剂。改变铁钴的物质的量比,测定相同时间内CO2的消耗率和含碳产物的占比,结果如下:
n(Fe):n(Co) | CO2消耗率/% | 含碳产物占比/% | ||
CO | C2H4 | CH4 | ||
100:0 | 1.1 | 100 | 0 | 0 |
50:50 | 30.5 | 36.8 | 20.3 | 42.9 |
0:100 | 69.2 | 2.7 | 0.2 | 97.1 |
结合数据,推测催化剂中钴的作用:__。
【题目】“绿水青山就是金山银山”,研究NOx、SO2等大气污染物的妥善处理具有重要意义。
CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气。
有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
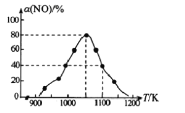
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为______________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数________(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =________(计算结果用分数表示)
=________(计算结果用分数表示)