��Ŀ����
18�������������������������й㷺Ӧ�ã���1��п-�̼��Ե�ع㷺Ӧ�����ճ������ص��ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+2H2O��l���TZn��OH��2��s��+2MnOOH��s�����õ�ص�������ӦʽΪMnO2+H2O+e-=MnOOH+OH-��
��2��ijѧϰС�����ԷϾɸɵ��Ϊԭ����ȡ�̣�����������ͼ1��

�ټ���Ũ�������ڷϾɵ���ں�ɫ���ʹ����б���ͨ�磬��ԭ���Ƕ���������Ũ���ᷴӦ������ж���������
�ڴӲ�Ʒ���ȡ������ȽǶȿ��ǣ�X��ѡ��C������ţ���
A����̿ B���� C������ D��һ����̼
��д��̼�����ڿ����������������������̵Ļ�ѧ����ʽ6MnCO3+O2$\frac{\underline{\;����\;}}{\;}$2Mn3O4+6CO2��
��3�������������Һ�������ֽ�ʪ��ұ�̣������̿���Ҫ�ɷ���MnCO3����Ҫ������Fe2+��Co2+��Ni2+��Ϊԭ���Ʊ��̵Ĺ���������ͼ2��
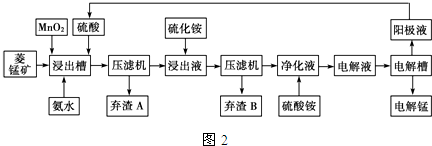
��֪��NiS��CoS��������ˮ���������������pH���������ij����Ũ��С�ڵ���10-5mol•L-1������Ϊ��ȫ������
| ���� | Fe��OH��2 | Ni��OH��2 | Co��OH��2 | Mn��OH��2 | Fe��OH��3 |
| ��ʼ����pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| ��ȫ����pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
�ڼ��백ˮ���ڽ���������Һ��pH��Χ��3.8��pH��8.3��
������B���ܺ��е�����ΪNiS��CoS��
�ܵ��������ĵ缫��ӦʽΪMn2++2e-=Mn��
���� ��1���ɵ�ط�Ӧʽ��֪��Ӧ��MnԪ�ػ��ϼ۽��ͣ�����ԭ����MnOOH��Ϊԭ���������Ӧ��
��2��Ũ��������������ڼ��������·�Ӧ������������Һ�к����Ȼ��̣�����̼��刺�����̼���̣������£�����Mn3O4��������Ȼ�ԭ������Mn��
��Ũ������������̷�Ӧ�����������������ж����壬����Ũ�����ܽ��������ʱҪ����ͨ�磬�����ж���
�ڽ�̿������ԭ����������ʱ��Ʒ�л��й������ʣ�CO�ж�������Ⱦ����������������ԭ���������̣�
��̼�����ڿ���������ʱ���������뷴Ӧ��
��3���̵���Ҫ��ʯ�����̿���Ҫ�ɷ�MnO2�������̿���Ҫ�ɷ�MnCO3��������������̡�����Ͱ�ˮ�ڽ������з�Ӧ��ͨ�����Ͻ�ȡ�������������������ӡ������������Һ���õ���Ʒ��
���ݼ������ӳ�����pH����֪���������������������У����������ѿ�ʼ��������ˣ�Ҫ����������ת���������ӣ�
�ڴ�pH��Χ��Co2+��Ni2+����û����ȫ���������������Һ���ڳ�������Co2+��Ni2+���ö��Ե缫���ϵ����������Һʱ�������������ӷ�����ԭ��Ӧ�������Ϸ���������Ӧ��2H2O-4e-=4H++O2�������������������ᣬ����ѭ��ʹ�ã�
��� �⣻��1���ɻ��ϼ۱仯��֪��MnԪ�ػ��ϼ���+4�۽��͵�+3�ۣ�ӦΪԭ���������Ӧ���缫����ʽΪMnO2+H2O+e-=MnOOH+OH-��
�ʴ�Ϊ��MnO2+H2O+e-=MnOOH+OH-��
��2����Ũ������������̷�Ӧ�����������������ж����壬����Ũ�����ܽ��������ʱҪ����ͨ�磬�����ж���
�ʴ�Ϊ������������Ũ���ᷴӦ������ж���������
�ڽ�̿������ԭ����������ʱ��Ʒ�л��й������ʣ�CO�ж�������Ⱦ����������������ԭ���������̣��ʴ�Ϊ��C��
��̼�����ڿ���������ʱ���������뷴Ӧ����Ӧ�ķ���ʽΪ6MnCO3+O2$\frac{\underline{\;����\;}}{\;}$2Mn3O4+6CO2���ʴ�Ϊ��6MnCO3+O2$\frac{\underline{\;����\;}}{\;}$2Mn3O4+6CO2��
��3���ٶ������̾��������ԣ��ܽ�������������Ϊ���������ӣ�MnO2�ܳ�ȥ���̿�������ȡҺ�е�Fe2+���ó��ӹ��̵����ӷ���ʽ�ǣ�MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O��
�ʴ�Ϊ��MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O��
�ڰ�ˮ���Խ������ӳ���������������Ksp=c3��OH-��•c��Fe3+������������ȫ����ʱ�������ӵ�Ũ����1��10-5mol/L����ʱc��OH-��=$\root{3}{\frac{1{0}^{-38.55}}{1{0}^{-5}}}$��10-11.2mol/L������c��H+��=10-3.8mol/L������pH=3.8�����Խ������ӳ�����ȫ������������δ�����ķ�Χ��3.8��8.3���ʴ�Ϊ��3.8��pH��8.3��
���ڴ�pH��Χ��Co2+��Ni2+����û����ȫ���������������Һ���ڳ�������Co2+��Ni2+������NiS��CoS���ʴ�Ϊ��NiS��CoS��
�ܸ��ݵ��صĹ���ԭ�������������������Һ�����̡����ᣬ����������ԭ��Ӧ���缫����ʽΪMn2++2e-=Mn���ʴ�Ϊ��Mn2++2e-=Mn��
���� ���⿼���������Ʊ�������ƣ�Ϊ��Ƶ���㣬������ѧ���ķ�����ʵ�������Ŀ��飬��Ŀ�漰���ӷ���ʽ����д���缫��Ӧʽ����д��֪ʶ����Ŀ�Ѷ��еȣ�ע�����ʵ��������Լ�������ʵ����ʣ�

S��s��+2KNO3��s��+3C��s���TK2S��s��+N2��g��+3CO2��g����H=x kJ•mol-1
��֪��
̼��ȼ���ȡ�H1=a kJ•mol-1
S��s��+2K��s���TK2S��s����H2=b kJ•mol-1
2K��s��+N2��g��+3O2��g���T2KNO3��s����H3=c kJ•mol-1
��x��������
| A�� | 3a+b-c | B�� | c-3a-b | C�� | a+b-c | D�� | c-a-b |
| A�� | NaHSO4��Һ��Ba��OH��2��Һ��Ӧ | B�� | C6H5ONa��Һ��CO2��Ӧ | ||
| C�� | NaAlO2��Һ��CO2��Ӧ | D�� | Fe��ϡ���ᷴӦ |
| A�� |  ̽��ԭ���ԭ�� ̽��ԭ���ԭ�� | B�� |  �Ʊ���ˮ�Ȼ��� | C�� |  ̽������ˮ��Ӧ ̽������ˮ��Ӧ | D�� |  �ռ����� �ռ����� |
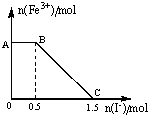 ��һ�����������ữ��KMnO4��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ�������й�˵������ȷ���ǣ�������
��һ�����������ữ��KMnO4��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ�������й�˵������ȷ���ǣ�������| A�� | ͼ��AB�η������ǹ���������KMnO4��Һ��KI�ķ�Ӧ | |
| B�� | �����п��Եó���ԭ�ԣ�I-��Fe2+��Mn2+ | |
| C�� | ȡB���Ժ��������Һ���뼸��KSCN��Һ����Һ���ɫ | |
| D�� | ����OC�ε����ݿ�֪����ʼ�����KMnO4�����ʵ���Ϊ0.5mol |
| A�� | ����0.1mol•L-1Ī������Һ500mL����Ī����19.6�� | |
| B�� | ���뺬Fe2+��HClO��H+��Cl-������Һ�������� | |
| C�� | �������Ba��OH��2��Һ������Ӧ��2Ba2++2SO42-+Fe2++2OH-=2BaSO4��+Fe��OH��2�� | |
| D�� | ȡ��������ŨNaOH��Һ�����ȣ����ֿ�����ɫʯ����ֽ�������壬֤����NH4+ |
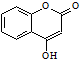 ��һ��ҽҩ�м��壮�������Ʊ�����Ѫҩ����ͨ������·�ߺϳɣ�
��һ��ҽҩ�м��壮�������Ʊ�����Ѫҩ����ͨ������·�ߺϳɣ�

 ���Ҵ�Ϊԭ�ϣ��Ʊ�
���Ҵ�Ϊԭ�ϣ��Ʊ�  �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�CH2=CH2$\stackrel{HBr}{��}$ CH3CH2Br$��_{��}^{NaOH}$CH3CH2OH��
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�CH2=CH2$\stackrel{HBr}{��}$ CH3CH2Br$��_{��}^{NaOH}$CH3CH2OH��