题目内容
8.CO2和NH3是工业上制备尿酸的重要原料,液态氨发生自偶电离:2NH3(l)═NH4++NH2-,NH4+的立方体构型是正四面体,NH2-的VSEPR模型是正四面体.分析 根据价层电子对互斥理论判断中心原子杂化方式和离子的空间构型,价层电子对数=成键电子对数+孤电子对数.
解答 解:NH4+中N原子的价层电子对数=4+$\frac{1}{2}$(5-1-4×1)=4,属于sp3杂化,不含有孤电子对,所以离子的空间构型为正四面体形;
NH2-中N原子的价层电子对数=2+$\frac{1}{2}$(5+1-2×1)=4,属于sp3杂化,则NH2-的VSEPR模型是正四面体形;
故答案为:正四面体;正四面体.
点评 本题考查了价层电子对互斥理论的应用,题目难度不大,注意把握分子或离子的空间构型与VSEPR模型的区别.

练习册系列答案
相关题目
18.二氧化锰在生产、生活中有广泛应用.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:
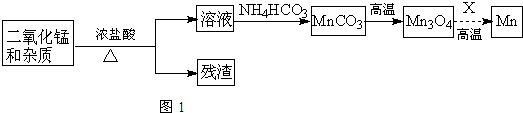
①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:
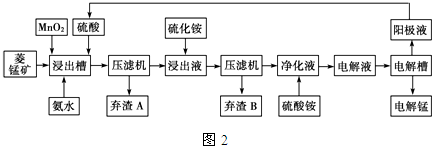
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
①用离子方程式表示加入二氧化锰的作用MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O.
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:

已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
19.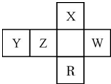 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |
13.下列叙述错误的是( )
| A. | 向蛋白质溶液中加入CuSO4溶液,蛋白质发生变性 | |
| B. | 一定条件下,乙醇能被氧化成一种刺激性气味的液体 | |
| C. | 用Cl2和NaOH溶液为原料制备次氯酸钠 | |
| D. | 海水提溴和生产玻璃过程中均涉及氧化还原反应 |
18.下列有机物的命名错误的是( )
| A. | 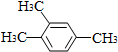 1,2,4-三甲苯 | B. | 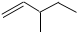 3-甲基戊烯 | C. | 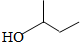 2-甲基-1-丙醇 | D. |  1,3-二溴丙烷 |