题目内容
3.莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列有关说法正确的是( )| A. | 配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 | |
| B. | 可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 | |
| C. | 加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ | |
| D. | 取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
分析 A.结合m=cVM计算;
B.HClO具有氧化性;
C.加入过量Ba(OH)2溶液,漏写铵根离子与碱的反应;
D.加入浓NaOH溶液并加热,生成氨气.
解答 解:A.配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐为0.1mol×0.5L×392g/mol=19.6克,故A正确;
B.HClO具有氧化性,与Fe2+发生氧化还原反应,不能大量共存,故B错误;
C.加入过量Ba(OH)2溶液,漏写铵根离子与碱的反应,则离子反应为2Ba2++2SO42-+2NH4++Fe2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3.H2O,故C错误;
D.加入浓NaOH溶液并加热,生成氨气,可使红色石蕊试纸变蓝的气体,以此检验NH4+,故D错误;
故选A.
点评 本题考查较综合,涉及离子反应、离子共存、离子检验及溶液配制等,综合性较强,注重基础知识和高频考点的考查,题目难度不大.

练习册系列答案
相关题目
16.下列制作铅笔的材料与相应工业不对应的是( )
| A. | 橡皮擦--橡胶工业 | B. | 铝合金片--冶金工业 | ||
| C. | 铅笔芯--电镀工业 | D. | 铅笔漆--涂料工业 |
14.室温下,下列溶液中粒子浓度大小关系正确的是( )
| A. | Na2S溶液中,2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | 强碱弱酸盐NaA溶液的pH=8,则c(OH-)-c(HA)=1,0×10-8mol/L | |
| C. | KAl(SO4)2溶液中,c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| D. | 向100ml pH=12 的 NaOH溶液中加入pH=2的醋酸溶液至中性,所得溶液的总体积大于200ml |
11.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | H、D、T三种氢的核素在周期表中的位置不同 | |
| B. | 元素简单气态氢化物越稳定,则非金属性越强 | |
| C. | 核外电子层结构相同的离子,核电荷数越大其离子半径也越大 | |
| D. | ⅠA与ⅦA元素形成的化合物都是离子化合物 |
18.二氧化锰在生产、生活中有广泛应用.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:
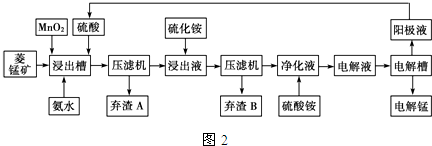
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
①用离子方程式表示加入二氧化锰的作用MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O.
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:

已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
8. 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
(査阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关)
I.电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,该电极的电极反应式为:Fe2++2e-=Fe
Ⅱ.电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉一KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,巧液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示)
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3%
猜想②:Fe2+在阳极直接放电生成Fe3+
猜想③:…
(3)设计实验验证猜想①
供选择的试剂:1mol/LFeS04溶液、lmoi/L 盐酸、2mol/L 盐酸、lmol/LNaCl 溶液、2moJ/L NaCl溶液、淀粉一KI溶液、KSCN溶液,蒸馏水
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(査阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关)
I.电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,该电极的电极反应式为:Fe2++2e-=Fe
Ⅱ.电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉一KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,巧液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示)
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3%
猜想②:Fe2+在阳极直接放电生成Fe3+
猜想③:…
(3)设计实验验证猜想①
供选择的试剂:1mol/LFeS04溶液、lmoi/L 盐酸、2mol/L 盐酸、lmol/LNaCl 溶液、2moJ/L NaCl溶液、淀粉一KI溶液、KSCN溶液,蒸馏水
| 操作 | 现象和结论 |
| ①取-定量2mol/L NaCl溶液,调 节溶液pH为4.91:再以相间装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液,滴入淀粉KI溶液 | |
15.下列说法正确的是( )
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
12.某课外实验小组设计的下列实验合理的是( )
| A. |  比较非金属性强弱Cl>C>Si | B. |  制备少量氨气 | ||
| C. |  实验室制氯气 | D. |  实验室制二氧化碳 |
13.下列叙述错误的是( )
| A. | 向蛋白质溶液中加入CuSO4溶液,蛋白质发生变性 | |
| B. | 一定条件下,乙醇能被氧化成一种刺激性气味的液体 | |
| C. | 用Cl2和NaOH溶液为原料制备次氯酸钠 | |
| D. | 海水提溴和生产玻璃过程中均涉及氧化还原反应 |