题目内容
10.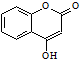 是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
①A与银氨溶液反应有银镜生成,则A的结构简式是CH3CHO.
②B→C的反应类型是取代反应.
③D→E的反应方程式

④1molF最多消耗3molNaOH溶液.
⑤下列关于G的说法错误的是c
a.能与溴水反应 b.能与金属钠反应
c.1mol G最多能和5mol氢气反应 d.分子式是C9H6O3
写出以
 和乙醇为原料,制备
和乙醇为原料,制备  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
分析 A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知,A与氧气反应可以生成乙酸,则A为CH3CHO,由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,D与甲醇在浓硫酸条件下发生酯化反应生成E,E的结构为 ,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,F中存在酯基,在碱液中可以发生水解反应,以
,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,F中存在酯基,在碱液中可以发生水解反应,以 和乙醇为原料,制备
和乙醇为原料,制备  ,可以将
,可以将 在碱性条件下水解得苯甲醇,再氧化得苯甲酸,再与乙醇发生酯化反应得产品,据此答题.
在碱性条件下水解得苯甲醇,再氧化得苯甲酸,再与乙醇发生酯化反应得产品,据此答题.
解答 解:A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知,A与氧气反应可以生成乙酸,则A为CH3CHO,由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,D与甲醇在浓硫酸条件下发生酯化反应生成E,E的结构为 ,
,
①由以上分析可知A为CH3CHO,故答案为:CH3CHO;
②由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,故答案为:取代反应;
③在浓硫酸作催化剂、加热条件下,邻羟基苯甲酸和甲醇发生酯化反应生成邻羟基苯甲酸甲酯和水,其反应方程式为: ,
,
故答案为: ;
;
④F中存在酯基,在碱液中可以发生水解反应,方程式为: ,所以1molF最多消耗3molNaOH,
,所以1molF最多消耗3molNaOH,
故答案为:3;
⑤根据G的结构简式:a.G中有碳碳双键,能与溴水发生加成反应,故a正确;b.G中有羟基,能与金属钠反应,故b正确;c.1mol G最多能和4mol氢气反应,故c错误;d.G的分子式是C9H6O3,故d正确,故选c;
以 和乙醇为原料,制备
和乙醇为原料,制备  ,可以将
,可以将 在碱性条件下水解得苯甲醇,再氧化得苯甲酸,再与乙醇发生酯化反应得产品,合成的路线流程图为
在碱性条件下水解得苯甲醇,再氧化得苯甲酸,再与乙醇发生酯化反应得产品,合成的路线流程图为 ,
,
故答案为:c; ;
;
点评 本题考查有机物的推断与合成,为高考常见题型,综合考查学生分析问题的能力和化学知识的综合运用能力,题目难度中等,答题注意注意仔细审题,把握题给信息.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:
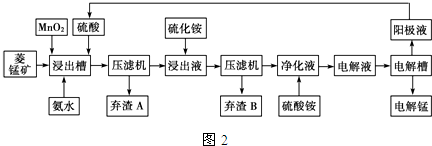
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)P位于元素周期表第三周期第ⅤA族;Cr的基态原子价层电子排布式是3d54s1.O的一种18电子结构氢化物的电子式是
 .
.(2)用“>”“<”填空:
| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
(4)已知:
3Fe(s)+2O2(g)=Fe3O4(s)△H=-1118.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-438.6kJ/mol,
则3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的△H=-151.2KJ/mol.
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |

 .
.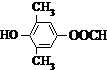 或
或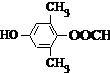 .
.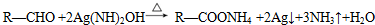 .
.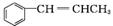 为原料制备
为原料制备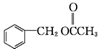 的合成路线流程图如下,试在方框内补充有机物的结构简式:
的合成路线流程图如下,试在方框内补充有机物的结构简式: