题目内容
11.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1
已知:
碳的燃烧热△H1=a kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
| A. | 3a+b-c | B. | c-3a-b | C. | a+b-c | D. | c-a-b |
分析 碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),其反应热进行相应的改变,据此计算反应热.
解答 解:碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=x kJ•mol-1=(3a+b-c)kJ•mol-1,所以x=3a+b-c,故选A.
点评 本题考查盖斯定律的应用,侧重考查学生分析计算能力,明确目标方程式与已知方程式的关系是解本题关键,注意方程式可以进行加减,题目难度不大.

练习册系列答案
相关题目
19.下列物质在生话中应用时,起还原作用的是( )
| A. | 明矾作净水剂 | B. | 甘油作护肤保湿剂 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
6.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
16.下列制作铅笔的材料与相应工业不对应的是( )
| A. | 橡皮擦--橡胶工业 | B. | 铝合金片--冶金工业 | ||
| C. | 铅笔芯--电镀工业 | D. | 铅笔漆--涂料工业 |
3.下列说法不正确的是( )
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
20.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{b({V}_{0}-{V}_{1})}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{b({V}_{0}-{V}_{1})}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
18.二氧化锰在生产、生活中有广泛应用.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:
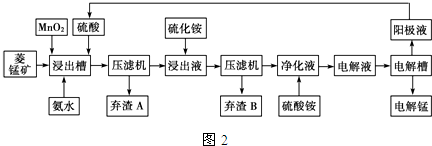
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
①用离子方程式表示加入二氧化锰的作用MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O.
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:

已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.

 .
. .
.
 (写结构简式)
(写结构简式)