题目内容
16.已知实验室制氯气反应原:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.①用双线桥法标出该反应中电子转移的方向和数目.
②该反应中Mn被还原,Cl被氧化
③氧化剂和还原剂的物质的量之比为:1:2
④在该反应中,若有2mol电子发生转移,在标准状况下,可生成Cl2的体积为:22.4L.
分析 ①该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2;
②得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化;
③该反应中氧化剂是二氧化锰、有一半的HCl作还原剂;
④该反应中每转移2mol电子就生成1mol氯气,根据V=nVm计算生成标况下Cl2的体积.
解答 解:①该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2,则转移电子方向和数目为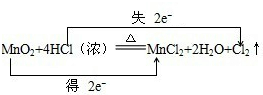 ,故答案为:
,故答案为: ;
;
②得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化,该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,所以Mn元素被还原、Cl元素被氧化,故答案为:Mn;Cl;
③该反应中氧化剂是二氧化锰、有一半的HCl作还原剂,所以氧化剂和还原剂的物质的量之比为1:2,故答案为:1:2;
④该反应中每转移2mol电子就生成1mol氯气,所以如果有2mol电子转移,则生成1mol氯气,V=nVm=1mol×22.4L/mol=22.4L,故答案为:22.4L.
点评 本题考查氧化还原反应计算,为高频考点,侧重考查基本概念、基本计算,明确元素化合价变化与概念之间关系是解本题关键,注意:该反应中有一半盐酸作还原剂,一半盐酸体现酸性.

练习册系列答案
相关题目
6.化学反应有自身规律,下列有关化学分应的叙述正确的是( )
| A. | 将二氧化碳通入次氯酸钙溶液可生成次氯酸 | |
| B. | 锂在氧气中燃烧主要生成Li2O2 | |
| C. | 二氧化硫通入氯化钙溶液可生成CaSO2沉淀 | |
| D. | 氯气通入硫酸铜溶液中能使Cu2+还原成Cu |
7.下列实验操作正确的是( )
| A. | 使用托盘天平称量12.5g样品时,先在左盘放置一定量样品,然后在右盘放置砝码和调节游码 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出即停止加热 | |
| C. | 用苯萃取碘水中的碘时,将碘的苯溶液从分液漏斗下口放出 | |
| D. | 金属钠需储存在盛有煤油的试剂瓶中 |
4.有机物其结构如图所示,下列关于该有机物的性质描述正确的是( )
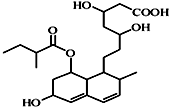

| A. | 不能使酸性KMnO4溶液褪色 | B. | 该有机物中-OH能氧化为-CHO | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
11.下列有关颜色的变化与氧化还原反应无关的是( )
| A. | 浓硝酸在光照下颜色会变黄 | |
| B. | 在滴有酚酞的NaOH溶液中,加入HCl溶液后溶液的红色褪去 | |
| C. | FeSO4溶液在空气中久置后变黄色 | |
| D. | 向FeSO4溶液中滴加NaOH溶液,生成沉淀由白色变成灰绿色,最后变成红褐色 |
1.将金属钠分别投入下列物质的稀水溶液中:①HCl ②K2SO4③MgCl2④CuCl2,能生成沉淀的是( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
8.大气层中存在大最的臭氧分子,其化学式为O3,其中O的化合价为( )
| A. | +3 | B. | +2 | C. | -2 | D. | 0 |