题目内容
6.回答下列问题(1)配平以下方程式:□K2Cr2O7+□HCl═□KCl+□CrCl3+□H2O+□Cl2↑
(2)以上反应中失电子的物质是HCl,还原产物是CrCl3,每生成
1mol这种还原产物,将有6mol电子发生转移;氧化剂与还原剂的物质的量之比为1:3.
(3)已知反应:2H2S+H2SO3═2H2O+3S↓,若氧化产物比还原产物多1.6g.则同时会生成水的质量为1.8g
(4)某反应体系中含有以下物质:FeCl3、HNO3、FeCl2、NO、Fe(NO3)3、H2O.已知反应前溶
液颜色为浅绿色,反应后溶液颜色为棕黄色,请用离子方程式表示反应过程:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
分析 (1)反应中氯从-1升为0价,2个氯离子共升高2价,铬元素化合价从+6降为+3,两个铬共降低6价,化合价升降最小公倍数为6,故K2Cr2O系数为1,CrCl3系数为2,Cl2系数为3,再根据元素守恒确定其它物质的系数,配平方程式;
(2)化合价升高元素失电子,所在的反应物是还原剂,化合价降低元素所在的产物是还原产物,所在的反应物是氧化剂,根据就方程式结合电子转移来计算;
(3)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,据方程式计算;
(4)反应前溶液颜色为浅绿色,反应后溶液颜色为棕黄色,则溶液是从亚铁离子转化为铁离子的过程,所以只能是硝酸将亚铁离子氧化的过程.
解答 解:(1)反应中氯从-1升为0价,2个氯离子共升高2价,铬元素化合价从+6降为+3,两个铬共降低6价,化合价升降最小公倍数为6,故K2Cr2O系数为1,CrCl3系数为2,Cl2系数为3,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为14,根据H元素可知H2O的系数为7,反应方程式为2K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,故答案为:2、14、2、2、3、7;
(2)以上反应中Cl原子失电子化合价升高,所在的反应物HCl是还原剂,化合价降低Cr元素所在的产物CrCl3是还原产物,所在的反应物K2Cr2O7是氧化剂,反应每生成1mol这种还原产物CrCl3,将有6mol电子发生转移,氧化剂与还原剂的物质的量之比为2:6=1:3,故答案为:HCl;CrCl3;6;1:3.
(3)反应2H2S+SO2═3S↓+2H2O中,生成3molS,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,同时会生成水2mol,若氧化产物比还原产物多1.6g,同时会生成水0.1mol,质量是1.8g,故答案为1.8g;
(4)反应前溶液颜色为浅绿色,反应后溶液颜色为棕黄色,则溶液是从亚铁离子转化为铁离子的过程,方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
点评 本题考查学生氧化还原反应中的概念以及电子转移的计算知识,属于综合知识的考查,难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 4:1 |
| 实验 | 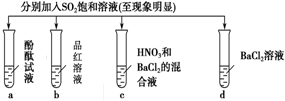 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在共价化合物分子中,一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 由不同元素组成的多原子分子里,一定只存在极性键 |
| A. | BaCl2 | B. | NaHCO3 | C. | Ba(OH)2 | D. | NaOH |
| A. | 2Na+2HCl═2NaCl+H2↑ | |
| B. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| C. | CuO+H2SO4═CuSO4+H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |